摘要:某固体物质跟浓H2SO4共热可生成一种酸性气体.若把氨水加到此物质的溶液中.先生成白色沉淀.继续加氨水沉淀消失.则此固体物质可能是 (A)MgCl2 (B)AlCl3 (C)AgNO3 (D)Cu(NO3)2
网址:http://m.1010jiajiao.com/timu3_id_332871[举报]
用如图所示装置可以完成一系列实验(图中夹持装置已略去)

请回答下列问题:
Ⅰ.(1)仪器p的名称是
(2)写出③中反应的离子方程式:
Ⅱ.若用装置A由浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液.
(1)仪器p中盛装试剂的化学式为
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式:
①处包有的某固体物质可能是(填序号)
a.MnO2 b.KMnO4 c.KCl d.Cu
(3)在实验过程中,在③处能观察到
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO-3,写出该反应的离子方程式:
查看习题详情和答案>>

请回答下列问题:
Ⅰ.(1)仪器p的名称是
分液漏斗
分液漏斗
,若用装置A由浓硫酸和亚硫酸钠固体制取SO2气体,并通过装置B完成表中设计实验,请填写表中空白:| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | 变红 变红 |
褪色 褪色 |
褪色 | 浅黄色 |
| 体现SO2的性质 | 水溶液显酸性 | 漂白性 | 还原性 还原性 |
氧化性 |
I2+SO2+2H2O═4H++SO2-4+2I-
I2+SO2+2H2O═4H++SO2-4+2I-
.Ⅱ.若用装置A由浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液.
(1)仪器p中盛装试剂的化学式为
浓H2SO4
浓H2SO4
.(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式:
Cl2+2I-═I2+2Cl-
Cl2+2I-═I2+2Cl-
.①处包有的某固体物质可能是(填序号)
b
b
.a.MnO2 b.KMnO4 c.KCl d.Cu
(3)在实验过程中,在③处能观察到
先由紫色变红色,后褪色
先由紫色变红色,后褪色
.(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO-3,写出该反应的离子方程式:
5Cl2+I2+6H2O═10Cl-+2IO-3+12H+
5Cl2+I2+6H2O═10Cl-+2IO-3+12H+
.(2011?东城区模拟)用如下装置可以完成一系列实验(图中夹持装置已略去).

请回答下列问题:
Ⅰ.若用装置A选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
II.若用装置A选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液.回答下列问题:
(1)p中盛装试剂为
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式
a.MnO2 b.KMnO4 c.KCl d.Cu
(3)在整个实验过程中,在③处能观察到
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式:
查看习题详情和答案>>

请回答下列问题:
Ⅰ.若用装置A选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | 褪色 | 浅黄色 | ||
| 体现SO2的性质 |
(1)p中盛装试剂为
浓硫酸
浓硫酸
.(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式
Cl2+2I-=2Cl-+I2
Cl2+2I-=2Cl-+I2
.①处包有的某固体物质可能是b
b
.a.MnO2 b.KMnO4 c.KCl d.Cu
(3)在整个实验过程中,在③处能观察到
先变红后褪色
先变红后褪色
.(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式:
5Cl2+I2+6H2O=12H++2IO3-+10Cl-
5Cl2+I2+6H2O=12H++2IO3-+10Cl-
.某固体物质和某浓酸在玻璃器皿中加热条件下反应,产生气体的相对分子质量或平均相对分子质量为28,则参加反应的两物质是( )
| A、Zn和浓H2SO4 | B、C和浓HNO3 | C、MnO2和浓盐酸 | D、Cu和浓H2SO4 |
(2009?肇庆一模)用如图装置进行实验,请回答下列问题:
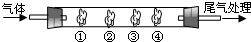
I.(1)若通入SO2气体,请填写表中空格:
(2)写出③中反应的离子方程式:
II.若通入HCl气体,装置中的四处棉花依次做了如下处理:①包有用水润湿某固体物质、②浸有KI溶液、③浸有石蕊溶液、④浸有浓NaOH溶液.请回答:
(1)观察到②处棕黄色物质产生,则:①处包有的某固体物质可能是下列的
a.MnO2 b.KMnO4 c.KCl d.Cu
(2)在实验过程中,在③处能观察到
(3)反应较长时间后,②处棕黄色褪去,生成无色的IO3-,该反应的离子方程式为
查看习题详情和答案>>

I.(1)若通入SO2气体,请填写表中空格:
| B中棉花的位置 | ① | ② | ③ | ④ |
| 棉花浸取试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | 变红 变红 |
褪色 褪色 |
褪色 | 浅黄色 |
| 体现SO2的性质 | 水溶液显酸性 | 漂白性 | 还原性 还原性 |
氧化性 |
I2+SO2+2H2O=SO42-+4H++2I-
I2+SO2+2H2O=SO42-+4H++2I-
II.若通入HCl气体,装置中的四处棉花依次做了如下处理:①包有用水润湿某固体物质、②浸有KI溶液、③浸有石蕊溶液、④浸有浓NaOH溶液.请回答:
(1)观察到②处棕黄色物质产生,则:①处包有的某固体物质可能是下列的
b
b
(填下面物质的序号),其反应的离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
.a.MnO2 b.KMnO4 c.KCl d.Cu
(2)在实验过程中,在③处能观察到
先变红后褪色
先变红后褪色
.(3)反应较长时间后,②处棕黄色褪去,生成无色的IO3-,该反应的离子方程式为
5Cl2+I2+6H2O=2IO3-+10Cl-+12H+
5Cl2+I2+6H2O=2IO3-+10Cl-+12H+
.用如图装置可以完成一系列实验(图中夹持装置已略去):

若装置A选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊试液、④蘸有浓NaOH溶液.
(1)p中盛装的试剂为
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式:
A.MnO2B.KMnO4C.KCl D.Cu
(3)在整个实验过程中,在③处能观察到的现象为
(4)反应较长时间后,②处棕黄色褪去,生成无色的I
,写出该反应的离子方程式:
查看习题详情和答案>>

若装置A选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊试液、④蘸有浓NaOH溶液.
(1)p中盛装的试剂为
浓硫酸
浓硫酸
.(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式:
Cl2+2I-=2Cl-+I2
Cl2+2I-=2Cl-+I2
.①处包有的某固体物质可能是b
b
(填字母).A.MnO2B.KMnO4C.KCl D.Cu
(3)在整个实验过程中,在③处能观察到的现象为
先变红后褪色
先变红后褪色
.(4)反应较长时间后,②处棕黄色褪去,生成无色的I
| O | - 3 |
5Cl2+I2+6H2O=12H++2IO3-+10Cl-
5Cl2+I2+6H2O=12H++2IO3-+10Cl-
.