网址:http://m.1010jiajiao.com/timu3_id_332529[举报]
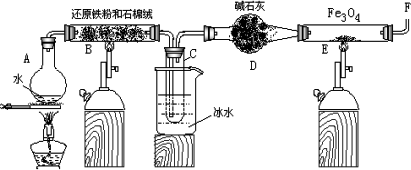
(1)为防止A中液体暴沸,可以采取的措施是___________;装置D能否改用盛有浓硫酸的洗气瓶___________。
(2)反应3Fe+4H2O(g)====Fe3O4+4H2↑在一定条件下实际为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释__________________________________。
(3)停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中含有Fe3+的实验操作及现象_____________________________________________________。
(4)若E管中反应按以下两步进行:Fe3O4+H2====3FeO+H2O,FeO+H2====Fe+H2O,假设实验开始时E管中的Fe3O4为23.
①Fe ②Fe租Fe3O4 ③FeO和Fe3O4 ④Fe和FeO ⑤Fe、FeO和Fe3O4
用此20 g固体与铝粉在一定条件下进行铝热反应,最多可消耗铝粉_________g(不考虑空气中的成分参与反应)。
查看习题详情和答案>>
| |||||||||||||||||||
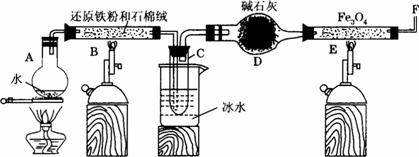
 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉.现用下图中甲、乙两套仪器装置制取上述铁的氧化物和细铁粉.制取上述铁的氧化物和细铁粉时必须使用普通铁粉和6mol?L-1盐酸,其他试剂任选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热装置等以及仪器中所装的试剂在图中均已略去).
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉.现用下图中甲、乙两套仪器装置制取上述铁的氧化物和细铁粉.制取上述铁的氧化物和细铁粉时必须使用普通铁粉和6mol?L-1盐酸,其他试剂任选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热装置等以及仪器中所装的试剂在图中均已略去).(1)甲、乙两套实验装置中有错误的装置是
装置改正后请回答下列问题:
(2)甲、乙两套装置中,在实验时需要加热的仪器是
(3)D管中发生反应的化学方程式为
| ||
| ||
(4)某兴趣小组为了确定实验后仪器D中黑色粉末的成分,他们进行了如下实验.

①操作①的名称是

②通过以上数据,可得出2.376g黑色粉末成分是
A.Fe3O4 B.Fe
C.Fe3O4与Fe的混合物 D.Fe3O4与Fe2O3的混合物.

(1)实验进行时试管A中应加入的试剂是
(2)实验时,U型管G中应加入的试剂是
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)
(4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是
(5)试管E中发生反应的化学方程式是
| ||
| ||
(6)为了安全,在E管中的反应发生前,在F出口处必须
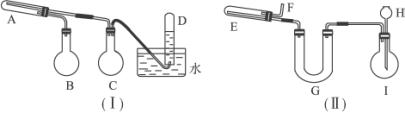
填写下列空白:
(1)实验进行时试管A中应加入的试剂是_____________,烧瓶B的作用是_______________,烧瓶C的作用是________________________,在试管D中收集得到的是________________。
(2)实验时,U形管G中应加入的试剂是_____________,长颈漏斗H中应加入_____________。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母) ___________________。
(4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是_________________________。
(5)试管E中发生反应的化学方程式是_____________________________________________。
(6)为了安全,在E管中的反应发生前,在F出口处必须________________;E管中的反应开始后,在F出口处应________________________________。
查看习题详情和答案>>