网址:http://m.1010jiajiao.com/timu3_id_330149[举报]
我们接触化学已有一月有余,知道了实验室制取气体的发生装置和收集装置有如下一些:
一、气体发生装置
在初中化学里,根据反应物状态和反应条件(是否需加热),主要掌握两种发生装置。
①固―固加热型如图A1;②固―液不加热型如A2或A3。

A1 A2 A3
二、气体的收集装置
气体的收集装置选择依据气体的水溶性和密度。
①凡难溶或不溶于水且不跟水发生反应的气体可用排水法收集,如图B1。
②比空气密度大的气体可用向上排空气法收集,如图B2。
③比空气密度小的气体可用向下排空气法收集,如图B3。

(1)小明同学用双氧水和二氧化锰混合来制取氧气,他应写出的文字表达式或化学方程式为___________,在这个反应中二氧化锰是_______,选择的发生装置是_____(填序号),能用B2收集的原因是___________。
(2)氨气是一种无色、有刺激性气味,极易溶于水,密度比空气小的气体。小玲用加热氯化铵和碱石灰(均为固体)的方法制取氨气,小玲应选择的发生装置是____和收集装置是____(填序号)。若用图F装置收集氨气,氨气应从____端进入(选填“a”或“b”,下同)。若用图F装置收集氧气,氧气应从____端进入。现小丁同学想收集一定体积的氧气,她将F装置装满水后气体应从______端进入;另外还需要增加什么仪器________。
(3)实验室存放的双氧水久置后容易分解而变稀。小丁同学向盛5%双氧水溶液(久置)的试管中加入少量二氧化锰,然后将带火星的木条伸入试管,未见木条复燃。你认为带火星的木条未复燃的原因是________。要使带火星的木条复燃,可对该实验作怎样的改进? ________。
(4)小燕同学用A3装置制取了一瓶无色无味的气体Y(纯净物),请按要求填写下表:

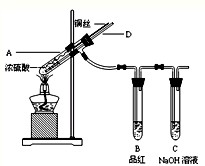 某实验小组同学为了探究铜与浓硫酸的反应,进行如下实验.
某实验小组同学为了探究铜与浓硫酸的反应,进行如下实验.实验1:铜与浓硫酸反应,实验装置如图所示.
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面.
(1)装置A中发生反应的化学方程式为
| ||
| ||
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是:
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是
实验2:实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜及氧化亚铜.
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜.
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行下图实验:
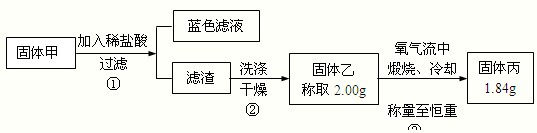
(4)过滤所需的玻璃仪器有
(5)②中检验滤渣是否洗涤干净的实验方法是
(6)③中在煅烧过程中一定存在的反应的化学方程式为
| ||
| ||
(7)下列对于固体甲的成分的判断中,正确的是(填字母选项)
A.固体甲中,CuS和Cu2S不能同时存在
B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若存在Cu2O,也可能有Cu2S
D.固体甲中若没有Cu2O,则一定有Cu2S.
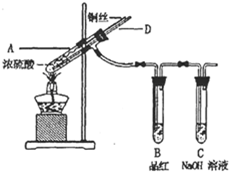 (2012?长沙模拟)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验.
(2012?长沙模拟)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验.【实验1】铜与浓硫酸反应,实验装置如图所示.
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面.
(1)装置A中发生反应的化学方程式为
| ||
| ||
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜.
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜.
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行如图的实验:
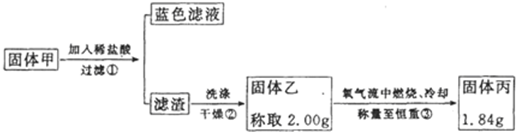
(4)②中检验滤渣是否洗涤干净的实验方法是
(5)③中在煅烧过程中一定发生的反应的化学方程式为
| ||
| ||
(6)下列对于固体甲的成分的判断中,不正确的是(填字母选项)
A.固体甲中,CuS和Cu2S不能同时存在
B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S
D.固体甲中若存在Cu2O,也可能有Cu2S.

请回答:
(1)将Y的饱和溶液滴入沸水中,继续加热可得红褐色液体,此液体不具有的性质是
A.光束通过该液体时形成光亮的“通路”
B.插入电极通过直流电后,有一极附近液体颜色加深
C.向该液体中加入硝酸银溶液,无沉淀产生
D.将该液体加热蒸干、灼烧后,有氧化物生成
(2)①单质甲、乙和Y溶液中的阳离子氧化性由强到弱的顺序为:
②少量单质甲通入X溶液中发生的离子方程式为
(3)实验室制备、收集纯净干燥的甲单质,所需仪器如图2,装置A为发生装置;除装置A中所需的药品外,其他装置中供选择的药品有:浓硫酸、碱石灰、五氧化二磷、饱和食盐水、氢氧化钠溶液.
①装置A中发生反应的化学反应方程式:
| ||
| ||
②按气流的方向连接各仪器接口,顺序为a→
③指出装置B、C、E中的药品(从提供的药品中选择):
B:

(一)溴乙烷的制备及产物的检验:设计了如图1装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤,回答下列问题:
(1)仪器A的名称是
(2)制备操作中,加入的少量的水,其目的是
a.减少副产物烯和醚的生成
b.减少Br2的生成
c.减少HBr的挥发
d.水是反应的催化剂.
(3)加热片刻后,A中的混合物出现橙红色,该橙红色物质可能是
(4)理论上,上述反应的副产物还可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、溴化氢等.
①检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验.B、C中应盛放的试剂分别是
②检验副产物中是否含有乙醚:通过红外光谱仪鉴定所得产物中含有“-CH2CH3”基团,来确定副产物中存在乙醚.请你对该同学的观点进行评价:
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是
a.NaI b.NaOH c.NaHSO3 d.KCl
(二)溴乙烷性质的探究:
用如图2实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
Ⅰ:在试管中加入10mL6mol/L NaOH溶液和2mL 溴乙烷,振荡.
Ⅱ:将试管如图2所示固定后,水浴加热.
(1)观察到
(2)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图3装置.A试管中的水的作用是