摘要:解:设参加反应的Ba(OH)2的质量为x 生成的BaSO4质量为:20 g+30 g-47.67 g=2.33 g -------- Ba(OH)2 + H2SO4= BaSO4↓+2H2O ------------- 171 233 x 2.33 g = ---------------------- x=1.71 g ------------------------ Ba(OH)2的溶质质量分数=1.71 g÷25 g×100%=6.84% ------ 答:该溶液中Ba(OH)2的溶质质量分数为6.84%.
网址:http://m.1010jiajiao.com/timu3_id_32918[举报]
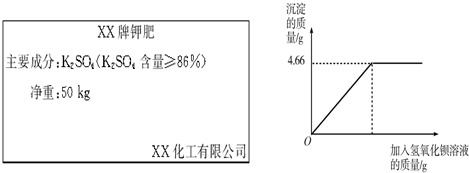
对化肥的销售,国家有明确的质量要求.某农业科技人员对农民买来的钾肥进行了检测,称取4.0g样品放入小烧杯中,加入适量水溶解后,与足量氢氧化钡溶液充分反应.产生沉淀的质量与所加氢氧化钡溶液质量的关系如图所示.(假设杂质不参加反应,反应方程式为:K2SO4+Ba(OH)2═BaSO4↓+2KOH)
(1).通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明.
(2).这样一袋化肥最多能提供钾元素的质量是 kg.
 查看习题详情和答案>>
查看习题详情和答案>>
(1).通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明.
(2).这样一袋化肥最多能提供钾元素的质量是
 查看习题详情和答案>>
查看习题详情和答案>>
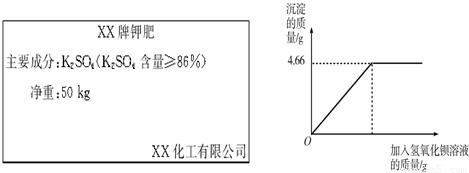
对化肥的销售,国家有明确的质量要求.某农业科技人员对农民买来的钾肥进行了检测,称取4.0g样品放入小烧杯中,加入适量水溶解后,与足量氢氧化钡溶液充分反应.产生沉淀的质量与所加氢氧化钡溶液质量的关系如图所示.(假设杂质不参加反应,反应方程式为:K2SO4+Ba(OH)2═BaSO4↓+2KOH)
(1).通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明.
(2).这样一袋化肥最多能提供钾元素的质量是______kg.
查看习题详情和答案>>
(1).通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明.
(2).这样一袋化肥最多能提供钾元素的质量是______kg.

查看习题详情和答案>>
(2013?内江)某化学实验活动小组的同学为了探究实验室中久置氢氧化钠固体的成分,进行了有关实验,请你参与他们进行的探究活动:
【猜想与假设】
猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3
猜想Ⅲ:
【实验与探究】
(1)实验如下:
(2)为了进一步的验证猜想结果,小明同学提出了如下实验方案:继续步骤二的实验,过滤,然后向滤液中滴加无色酚酞试液,若酚酞变红,则猜想Ⅲ成立;若酚酞不变红,则猜想Ⅱ成立.
小华同学立即对小明同学的方案提出了质疑,通过查阅资料知道,氯化钡溶液程中性,不能使无色酚酞试液变红,但碳酸钠溶液呈
(3)实验小组的同学展开讨论,又提出了一个定量试验方案,通过测定产生沉淀的质量来证明猜想Ⅱ或Ⅲ成立.试验如下:准确称量m克固体样品于试管中,加热蒸馏水完全溶解,然后滴加足量氯化钡溶液,充分反映后过滤、洗涤、干燥称的沉淀的质量为n克,若猜想Ⅱ成立,则m与n的关系式为(用含m和n的等式或不等式表示,下同)
【反思与交流】久置固体氢氧化钠变质的原因是(用化学方程式表示)
查看习题详情和答案>>
【猜想与假设】
猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3
猜想Ⅲ:
固体为氢氧化钠和碳酸钠
固体为氢氧化钠和碳酸钠
.【实验与探究】
(1)实验如下:
| 实验操作步骤 | 实验现象 | 结论及解释 |
| 步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸. | 实验过程中始终没有气泡产生. | 则证明猜想 Ⅰ Ⅰ 成立. |
| 步骤二:取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氢氧化钡溶液. | 实验过程中产生 白色沉淀 白色沉淀 . |
则证明猜想Ⅱ或Ⅲ成立,此过程中发生反应的化学方程式为 Na2CO3+Ba(OH)2═BaCO3↓+2NaOH Na2CO3+Ba(OH)2═BaCO3↓+2NaOH . |
小华同学立即对小明同学的方案提出了质疑,通过查阅资料知道,氯化钡溶液程中性,不能使无色酚酞试液变红,但碳酸钠溶液呈
碱
碱
性(填“酸”或“减”)能使酚酞变红.因此,他认为该方案的操作步骤中应该改进的是将步骤二中的氢氧化钡溶液改为加入过量的氯化钡溶液
将步骤二中的氢氧化钡溶液改为加入过量的氯化钡溶液
.(3)实验小组的同学展开讨论,又提出了一个定量试验方案,通过测定产生沉淀的质量来证明猜想Ⅱ或Ⅲ成立.试验如下:准确称量m克固体样品于试管中,加热蒸馏水完全溶解,然后滴加足量氯化钡溶液,充分反映后过滤、洗涤、干燥称的沉淀的质量为n克,若猜想Ⅱ成立,则m与n的关系式为(用含m和n的等式或不等式表示,下同)
n=
| 197m |
| 106 |
n=
;若猜想Ⅲ成立,则m与n的关系式又为| 197m |
| 106 |
n<
| 197m |
| 106 |
n<
.| 197m |
| 106 |
【反思与交流】久置固体氢氧化钠变质的原因是(用化学方程式表示)
2NaOH+CO2═Na2CO3+H2O
2NaOH+CO2═Na2CO3+H2O
.在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.

【知识回放】
通过判断上述四种溶液两两之间能否发生反应,我能写出其中符合下列条件的两个化学方程式:
(1)一个中和反应
(2)一个有沉淀生成的反应
【挖掘实质】
(1)图甲是HCl和NaOH在水中解离出离子的示意图,小丽发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是
(2)图乙是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H++OH-=H2O,我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成的反应的实质
【实践运用】
(1)通过上述探究发现,在溶液中H+和OH-不能大量共存,我还发现在溶液中
(2)利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液.经测定,该溶液显酸性.则在该溶液中一定含有的离子是
【知识升华】
对“复分解反应发生的条件”的再探究,我发现在分析多种溶液混合后所得溶液中离子的成分时,应考虑的因素是
查看习题详情和答案>>

【知识回放】
通过判断上述四种溶液两两之间能否发生反应,我能写出其中符合下列条件的两个化学方程式:
(1)一个中和反应
H2SO4+2NaOH=Na2SO4+2H2O
H2SO4+2NaOH=Na2SO4+2H2O
;(2)一个有沉淀生成的反应
H2SO4+Ba(NO3)2=BaSO4↓+2HNO3
H2SO4+Ba(NO3)2=BaSO4↓+2HNO3
.【挖掘实质】
(1)图甲是HCl和NaOH在水中解离出离子的示意图,小丽发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是
Ba2+和NO3-
Ba2+和NO3-
(填离子符号).(2)图乙是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H++OH-=H2O,我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成的反应的实质
2H++CO32-=H2O+CO2↑
2H++CO32-=H2O+CO2↑
.【实践运用】
(1)通过上述探究发现,在溶液中H+和OH-不能大量共存,我还发现在溶液中
Ba2+和SO42-或Ba2+和CO32-或H+和CO32-
Ba2+和SO42-或Ba2+和CO32-或H+和CO32-
(填离子符号,下同)也不能大量共存.(2)利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液.经测定,该溶液显酸性.则在该溶液中一定含有的离子是
H+、Na+、K+和NO3-
H+、Na+、K+和NO3-
.为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证.| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
可能性一:Ba2+ 可能性二:SO42- 可能性三:Ba2+或SO42- 可能性一:Ba2+ 可能性二:SO42- 可能性三:Ba2+或SO42- | ①取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+;若没有出现白色沉淀,则说明上述溶液中不含有Ba2+., ②取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. ③取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+,不含有SO42-. ①取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+;若没有出现白色沉淀,则说明上述溶液中不含有Ba2+., ②取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. ③取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+,不含有SO42-. |
对“复分解反应发生的条件”的再探究,我发现在分析多种溶液混合后所得溶液中离子的成分时,应考虑的因素是
溶液中的离子能否大量共存或者离子是否参加化学反应,参加化学反应的离子是否有剩余
溶液中的离子能否大量共存或者离子是否参加化学反应,参加化学反应的离子是否有剩余
.某化学活动小组欲用纯碱制取烧碱,做了如下实验
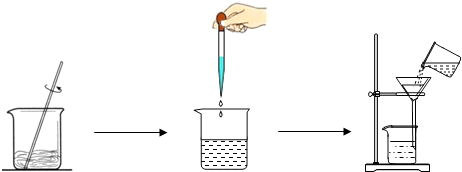
现取20g纯碱样品(假设杂质不溶于水,也不与其他物质反应),向其中加入34.1水使其完全溶解,然后再加入100g的溶质质量分数为l7.1%的氢氧化钡溶液,至恰好完全反应,过滤得到滤渣和一种不饱和溶液.请回答问题:
(1)上述实验步骤中,请指出操作中的错误
(2)请写出发生反应的化学方程式
(3)列出参加反应固体物质质量(x)的比例式为
=
=
;
(4)求纯碱样品的纯度为
(5)反应后所得溶液的溶质质量分数为
查看习题详情和答案>>

现取20g纯碱样品(假设杂质不溶于水,也不与其他物质反应),向其中加入34.1水使其完全溶解,然后再加入100g的溶质质量分数为l7.1%的氢氧化钡溶液,至恰好完全反应,过滤得到滤渣和一种不饱和溶液.请回答问题:
(1)上述实验步骤中,请指出操作中的错误
过滤时没用玻璃棒引流
过滤时没用玻璃棒引流
;(2)请写出发生反应的化学方程式
Na2CO3+Ba(OH)2═BaCO3↓+2NaOH
Na2CO3+Ba(OH)2═BaCO3↓+2NaOH
;(3)列出参加反应固体物质质量(x)的比例式为
| 106 |
| 171 |
| X |
| 17.1g |
| 106 |
| 171 |
| X |
| 17.1g |
(4)求纯碱样品的纯度为
53%
53%
;(5)反应后所得溶液的溶质质量分数为
6.4%
6.4%
.