网址:http://m.1010jiajiao.com/timu3_id_3271[举报]
解:设该纯碱样品中碳酸钠的质量为x,生成的氯化钠的质量为y,则( 0.5分 )
Na2CO3 +2 HCl = 2NaCl + H2O + CO2↑ (1分 )
106 117 44
x y 3.52g
![]()
![]()
x=8.48g ( 1 分 ) y=9.36g( 1 分 )
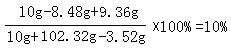 ( 1 分 )
( 1 分 )
纯碱(![]() )产品中常含有少量氯化钠。某厂生产的纯碱包装袋上标有“
)产品中常含有少量氯化钠。某厂生产的纯碱包装袋上标有“![]() 含量≥95%”字样。为判断该产品中
含量≥95%”字样。为判断该产品中![]() 的含量是否达到要求,称取5.0g样品进行检验,可供选取的装置如下图。其中,丙装置中装足量浓氢氧化钠溶液,丁装置中装浓硫酸,戊装置中装水。(提示:浓硫酸具有吸水性,不挥发,不与二氧化碳反应,碳酸钠受热不分解。)
的含量是否达到要求,称取5.0g样品进行检验,可供选取的装置如下图。其中,丙装置中装足量浓氢氧化钠溶液,丁装置中装浓硫酸,戊装置中装水。(提示:浓硫酸具有吸水性,不挥发,不与二氧化碳反应,碳酸钠受热不分解。)
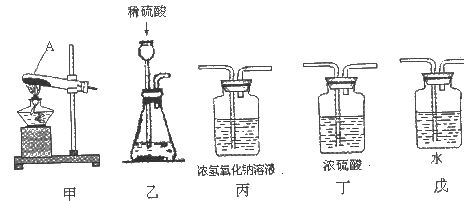
(1)写出上图仪器A的一种常见用途___________。
(2)你选择的实验装置从左到右组装排列为(填编号)___________。请说出你选择或排列装置的一点理由_________。
(3)假设每步都反应完全,生成的二氧化碳全部被吸收,不考虑空气中二氧化碳的影响。较准确地计算“![]() 含量≥95%”是否真实,该实验除称取样品质量外,还要用天平量得到的实验数据是 _________。
含量≥95%”是否真实,该实验除称取样品质量外,还要用天平量得到的实验数据是 _________。
(4)若乙装置中加入浓盐酸(有挥发性),对测量结果会产生影响。原因是浓盐酸挥发出的氯化氢气体__________。
(5)若实验装置连接正确,实验过程中看到丙装置出现的气泡比丁少得多,一种可能的原_____________。
查看习题详情和答案>>Ⅰ、甲组用下图装置通过测定气体质量再计算出纯碱的质量分数.

其主要步骤如下:
①按图组装仪器并检查气密性;
②称取m克试样放入锥形瓶中加适量蒸馏水使之完全溶解;
③称量装置D中装有碱石灰的U形管质量是a1克;
④从分液漏斗中慢慢滴加20%的稀硫酸
⑤从导管a中缓缓鼓入空气;
⑥再次称量装置D中装有碱石灰的U形管质量;
⑦重复⑤和⑥的操作,直到装置D中U形管质量基本不变,测得质量为a2克.
试回答相关问题:
(1)A装置中最好装
(2)装置C中浓硫酸的作用是
(3)步骤④中,从分液漏斗中慢慢滴加20%的稀硫酸直至观察到
(4)若没有步骤⑤会使测定结果
(5)E装置中碱石灰的作用是
(6)装置B中分液漏斗内的稀硫酸不能换成浓盐酸的理由是
Ⅱ、乙组用生成沉淀的方法来测定纯碱(Na2CO3)的质量分数,称取12.5克样品加入107.2克的氯化钡溶液恰好完全反应过滤得到的沉淀干燥后为19.7克和一定量滤液(设没有损失),试计算①样品中纯碱的质量分数;②滤液中溶质的质量分数.
(1)写出反应的化学方程式
(2)列出求解该样品中参加反应的碳酸钠质量(x)的比例式
(3)该样品中碳酸钠的质量分数为
(4)向反应后的固液混合物中加入128.2g水,充分搅拌后过滤,得到只含一种溶质的不饱和溶液,则所得不饱和溶液中溶质的质量分数为
(5)欲配制300g上述实验所用的稀盐酸,需要43.8%的浓盐酸质量为