网址:http://m.1010jiajiao.com/timu3_id_326495[举报]
 A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:
A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:(1)C在元素周期表中的位置为
(2)F单质的燃烧热△H=-akJ/mol,写出表示F单质的燃烧热的热化学方程式
(3)E单质与D的最高价氧化物的水化物的溶液反应的离子方程式为
(4)A、B两元素可形成离子化合物BA5,其电子式为
(5)将0.4mol FC2和0.2mol C2放入容积为2L的_密闭容器中,在一定条件下发生 反应2FC2+C2?2FC3,当FC2百分含量不变时,得到0.2mol FC3气体,则此时反应的平衡常数K=
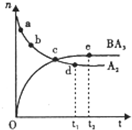
(6)向一绝热恒容密闭容器中通入B2和A2,在一定条件下发生反应B2(g)+3A2(g)?2BA3(g)△H<0,达到平衡,n(A2)和n(BA3)随时间变化的关系如图所示.下列有关叙述一定正确的是
A.c点表示BA3生成速率与BA3分解速率相等
B.c点和e点 A2的转化率相等
C.平衡后再升高温度,不利于BA3的合成
D.d点时:n(A2):n(BA3)=3:2
(7)将E元素的单质(除去氧化膜)投入浓的氯化铜溶液中,在其表面很 快出现一层红色物质,产生气体的速率逐渐加快,经检验,该气体为氢气,用温度计测得溶液的温度迅速升高.请从有关能量、是否有电化学作用等方面,分析能产生氢气且开始 阶段的速率不断加快的原因
A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28。请回答下列问题:
(1)B与D可形成非极性分子X,过量的X与F D2-溶液反应的离子方程式为____________________________。
(2)E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(3)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(4)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如右图所示。写出石墨(I)电极上发生的电极反应式: 。

(5)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为______。
(6)由A、C、D、E四种元素中任意三种构成的强电解质Z和W,溶于水时都能促进水的电离,测得Z的水溶液pH>7,W的水溶液pH<7,则Z为 、W为 。
(7)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g)![]() 2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol, A2 0.5mol, CA30mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L, CA3 0.1mol/L
②求算此平衡体系的平衡常数K=________;
查看习题详情和答案>>A、B、C、D、E五种物质是由常见元素组成,A由两种元素组成,且A中两种元素的质量比为7∶8。A和B在高温条件下反应生成C和D,C为无色气体,在标准状况下的密度约为2.86g∙L-1。以A为原料生产E。

⑴写出A的化学式:
⑵A和B的反应中,还原剂与氧化剂的物质的量之比为 ,
⑶某人设想用右图所示装置利用电化学原理生产E,则N电极是 极;写出M电极的电极反应式: 。
⑷当图中的C与O2被活性炭吸附时,也能发生反应生成F,为研究此反应,将C和O2放入体积为2L的恒容密闭容器中,在500℃时发生反应,反应过程中的能量变化如下图所示,反应物物质的量和时间的变化如下表所示:

①该反应的ΔH 0反应从起始至2min内的平均反应速率v(C)= ;
500℃时,此反应化学平衡常数K的值为 。
②第6min时,向容器中再充入0.002molO2,同时将反应体系的温度改变为T,反应至10min时重新达到平衡,此时测得c(C)=0.006mol∙L-1,则温度T (填“>”或“<”)500℃。
查看习题详情和答案>>
A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28。请回答下列问题:
(1)B与D可形成非极性分子X,过量的X与F D2-溶液反应的离子方程式为____________________________。
(2)E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(3)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(4)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如右图所示。写出石墨(I)电极上发生的电极反应式: 。

(5)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为______。
(6)由A、C、D、E四种元素中任意三种构成的强电解质Z和W,溶于水时都能促进水的电离,测得Z的水溶液pH>7,W的水溶液pH<7,则Z为 、W为 。
(7)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g) 2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
2CA3(g),反应达到平衡后,测得容器中含有C2 0.5mol,A20.2mol,CA30.2mol,总容积为1.0L。
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol, A2 0.5mol, CA30mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L, CA3 0.1mol/L
②求算此平衡体系的平衡常数K=________;
查看习题详情和答案>>
A、B、C、D、E、F是中学化学中常见的无色气体,它们均由短周期元素组成。A、B、C相互转化关系如图所示(部分产物已略去)。
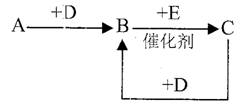
①A能使湿润的红色石蕊试纸变蓝;C、D为空气中的主要成分;B、E是有毒气体,它们的分子均由同周期元素原子构成。
②B和D相遇生成红棕色气体。
③F是形成酸雨的一种有害气体,有刺激性气味。
回答下列问题:
(1)C的电子式是 。
(2)写出A→B的化学方程式 。
(3)B和E发生反应的化学方程式是 。
(4)常温下,把一定量的A通入水中,测得溶液的pH=12,则该溶液中由水电离出的OH—浓度为 ;该溶液中,一定能大量共存的离子组是 (填序号)。
a.Na+ NO—3 Fe2+ C1— b.Ag+ Mg2+ Ca2+ NO—3
c.Al3+ K+ A1O—3 C1— d.CO2-3 Na+ K+ NO—3
(5)简述实验室验证F存在的方法 。
查看习题详情和答案>>