摘要:如图4-7所示.下列各容器中盛有水.铁在其中被腐蚀由快到慢的顺序为( ). A.④②③① B.④③①② C.③①②④ D.②①③④ 答案:B
网址:http://m.1010jiajiao.com/timu3_id_326316[举报]
加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g ·mL-1),在标准状况下放出气体的体积和时间的关系如图2-7所示,完成下列问题:
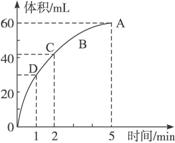
图2-7
(1)实验时放出气体的总体积为_________________。
(2)放出一半气体所需要的时间为_________________。
(3)反应放出3/4气体所需要的时间为_________________。
(4)A、B、C、D四点化学反应速率快慢的顺序为_________________。
查看习题详情和答案>>
加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g ·mL-1),在标准状况下放出气体的体积和时间的关系如图2-7所示,完成下列问题:
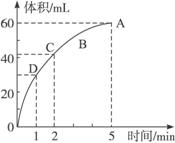
图2-7
(1)实验时放出气体的总体积为_________________。
(2)放出一半气体所需要的时间为_________________。
(3)反应放出3/4气体所需要的时间为_________________。
(4)A、B、C、D四点化学反应速率快慢的顺序为_________________。
查看习题详情和答案>>
有机化合物A为一种无色液体。从A出发可发生如图9-6所示的一系列反应。

图9-6
(1)写出有机物A、B、C的结构简式:_______________、_______________、_______________。
(2)写出下列转化的化学方程式:
反应①:
反应⑤:
(3)A的同分异构体有很多,下列为A的几种异构体:
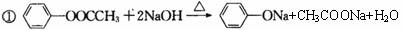
其中,能与溶液发生氧化还原反应的有_______________;能与NaOH溶液反应的有________。(填序号)
(4)上述同分异构体中的一种物质X可以发生如图9-7所示转化:
![]()
图9-7
X可能是________(填序号);W的结构简式为_______________。
查看习题详情和答案>> (2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.
(2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.(1)目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.已知常温常压下:
①CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H=-354.8kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
则反应2CO2(g)+4H2O(g)═2CH3OH(l)+3O2(g)△H=
+1275.6
+1275.6
kJ?mol-1(2)T℃时,已知反应:CO2(g)+H2(g)?CO(g)+H2O(g)△H<0.在T℃下,将2mol CO2和2mol H2充入1L的密闭容器中,测得H2的物质的量随时间的变化情况如图中曲线I所示.
①按曲线I计算反应从0到4min时,υ(H2)=
0.25mol/(L?min)
0.25mol/(L?min)
.②在T℃时,若仅改变某一外界条件时,测得H2的物质的量随时间的变化情况如图中曲线Ⅱ所示,则改变的外界条件为
增大二氧化碳的浓度
增大二氧化碳的浓度
.计算该反应按曲线II进行,达到平衡时,容器中c(CO2)=4.5mol/L
4.5mol/L
.(3)已知25℃时,乙酸和碳酸的电离平衡常数如下表:
| 物质的化学式 | CH3COOH | H2CO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
碱性
碱性
(填“酸性”、“碱性”或“中性”).②在25℃时,在乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的pH=6,那么混合液中
| c(CH3COO-) |
| c(CH3COOH) |
18
18
.③向0.1mol?L -1CH3COOH溶液中加入少量CH3COONa晶体,保持温度不变,下列有关说法正确的是
ad
ad
(填代号).a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)?c(H+)不变.