摘要:用锌片.铜片和AgNO3溶液组成的原电池.正极上发生的电极反应是( ). A.2H++2e-=H2 B.Zn-2e‑=Zn2+ C.2H2O+O2+4e-=4OH- D.Ag++e-=Ag 答案:D
网址:http://m.1010jiajiao.com/timu3_id_326304[举报]
(1)用锌片、铜片和稀盐酸组成的原电池,正极的电极反应式为
(2)选用下列试剂和仪器设计一个原电池.画出装置图.标明原电池的正极、负极、电解质溶液,并写出正极、负极的电极反应.
试剂:铜片、铁片、银片、镁条、硫酸铜溶液、硝酸银溶液.
仪器:烧杯、导线、铁夹(若还需其它仪器可自己补充)
查看习题详情和答案>>
2H++2e-=H2↑
2H++2e-=H2↑
,负极的电极反应式为Zn-2e-=Zn2+
Zn-2e-=Zn2+
,原电池的总反应是Zn+2H+=Zn2++H2↑
Zn+2H+=Zn2++H2↑
;当有6.5g锌溶解时,则在标准状况下,放出的氢气的体积为2.24L
2.24L
,转移的电子数为0.2
0.2
摩尔,溶液的酸性减弱
减弱
(填“增强”或“减弱”).(2)选用下列试剂和仪器设计一个原电池.画出装置图.标明原电池的正极、负极、电解质溶液,并写出正极、负极的电极反应.
试剂:铜片、铁片、银片、镁条、硫酸铜溶液、硝酸银溶液.
仪器:烧杯、导线、铁夹(若还需其它仪器可自己补充)
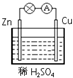 如图所示,在用锌片、铜片和稀硫酸组成的原电池装置中,下列说法正确的是( )
如图所示,在用锌片、铜片和稀硫酸组成的原电池装置中,下列说法正确的是( )