网址:http://m.1010jiajiao.com/timu3_id_325522[举报]
现有四种元素。其中两种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;另两种元素的特征电子构型为③2s22p3;④2s22p3;④2s22p5。则下列有关比较中正确的是
A.第一电离能:④>③>①>②
B.原子半径:②>①>③>④
C.电负性:③>④>①>②
D.最高正化合价:④>①>③=②
查看习题详情和答案>>(10分)X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
| 元素 | 相 关 信 息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y元素的激发态原子的电子排布式为1s22s22p63s23p34s1 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(1)Y元素基态原子的电子排布式为 。
(2)Y的简单离子半径 Z的简单离子半径(选填“>”、“=”、“<”)。
(3)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(4)向WYO4的水溶液中逐滴加入氨水至过量,观察到现象为 。反应过程中涉及的离子方程式为: 、
。
查看习题详情和答案>>
(10分)X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
|
元素 |
相 关 信 息 |
|
X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
Y元素的激发态原子的电子排布式为1s22s22p63s23p34s1 |
|
Z |
Z和Y同周期,Z的电负性大于Y |
|
W |
W的一种核素的质量数为63,中子数为34 |
(1)Y元素基态原子的电子排布式为 。
(2)Y的简单离子半径 Z的简单离子半径(选填“>”、“=”、“<”)。
(3)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(4)向WYO4的水溶液中逐滴加入氨水至过量,观察到现象为 。反应过程中涉及的离子方程式为: 、
。
查看习题详情和答案>>
碳、氧、铁、铜等是与人类生产、生活息息相关的化学元素。
(1)基态铜原子的价电子排布式为___________,铜原子的电子占有___________种能量不同的原子轨道。
(2)CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO分子中C原子的杂化类型为___________杂化。
(3)甲烷和四氯化碳具有相似的空间结构,但常温下甲烷是气体,四氯化碳是液体,其原因是________________ 。
(4)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。

表中的金属元素是_____________(填字母)。若A、B、C依次为同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是______________。
(5)元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是_____________ ;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为_______________。
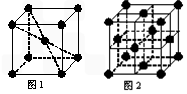
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为____________。
(1)金属钛(22Ti)将是继铜、铁、铝之后人类广泛使用的第四种金属,写出钛元素的基态原核外电子排布式:_______________
(2)日常生活中广泛应用的不锈钢,在其生产过程中添加了铬元素,该元素基态原子未成对电子数为_____________。
(3)COCl2俗称光气,分子中碳原子采取_____________杂化成键;其中碳氧原子之间的共价键含有____(填字母)。
a.2个σ键 b.2个π键 c.1个σ键、1个π键
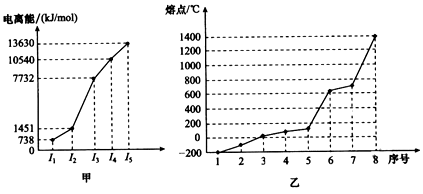
(4)①短周期某主族元素M的逐级电离能情况如图甲所示,则M元素形成化合物时表现的主要化合价为______价。
②第三周期8种元素按单质熔点高低的顺序如图乙所示,其中序号“8”代表_______(填元素符号,下同);其中电负性最大的是_________。
(6)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是_________________