摘要: (1)将废液中的Cu2+和Fe2+全部置换出来 (2)Zn+ CuSO4 = ZnSO4 +Cu (或Fe+CuSO4===Cu+FeSO4) (3)取步骤④的滤渣于试管中.加入少量稀硫酸.若有气泡产生.则酸不足量(或若无气泡产生.则酸已足量)
网址:http://m.1010jiajiao.com/timu3_id_32452[举报]
某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如下实验方案:
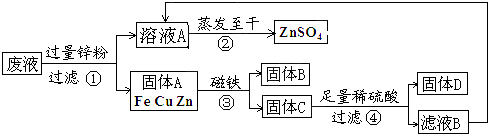
试回答:
(1)步骤①中锌粉必须过量的原因是
(2)写出步骤①进行分离的操作名称是
(3)要检验步骤④中加入的稀硫酸是否足量的方法是
(4)写出步骤①中任一个反应方程式:
(5)从步骤①和步骤④可得出三种金属的活动性顺序:
查看习题详情和答案>>

试回答:
(1)步骤①中锌粉必须过量的原因是
将废液中的Cu2+和Fe2+全部置换出来
将废液中的Cu2+和Fe2+全部置换出来
.(2)写出步骤①进行分离的操作名称是
过滤
过滤
.(3)要检验步骤④中加入的稀硫酸是否足量的方法是
继续加入少量稀硫酸,观察是否有气泡产生,如果没有气泡产生,说明稀硫酸足量
继续加入少量稀硫酸,观察是否有气泡产生,如果没有气泡产生,说明稀硫酸足量
.(4)写出步骤①中任一个反应方程式:
Zn+CuSO4═ZnSO4+Cu(或Zn+FeSO4═ZnSO4+Fe)
Zn+CuSO4═ZnSO4+Cu(或Zn+FeSO4═ZnSO4+Fe)
.(5)从步骤①和步骤④可得出三种金属的活动性顺序:
Zn>Fe>Cu
Zn>Fe>Cu
.(2011?滨州)某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如图的实验方案:

试回答:
(1)步骤①中锌粉必须过量的原因是
(2)写出步骤①中任一反应的化学方程式
(3)要检验步骤④中加入的稀硫酸是否足量的方法是
(4)若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量
查看习题详情和答案>>

试回答:
(1)步骤①中锌粉必须过量的原因是
将废液中的Cu2+和Fe2+全部置换出来
将废液中的Cu2+和Fe2+全部置换出来
.(2)写出步骤①中任一反应的化学方程式
Zn+CuSO4=ZnSO4+Cu(或Fe+CuSO4═Cu+FeSO4)
Zn+CuSO4=ZnSO4+Cu(或Fe+CuSO4═Cu+FeSO4)
.(3)要检验步骤④中加入的稀硫酸是否足量的方法是
取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生,则酸不足量(或若无气泡产生,则酸已足量)
取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生,则酸不足量(或若无气泡产生,则酸已足量)
.(4)若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量
>
>
(填“>”、“<”或“=”)原废液中硫酸锌的质量.要计算该废液中硫酸铜质量,必须要称量固体D(或铜)
固体D(或铜)
的质量.(2013?常熟市模拟)某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如图1实验方案: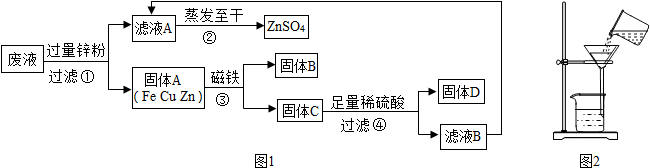
试回答:
(1)步骤①中锌粉必须过量的原因是
(2)写出步骤①中任一反应的化学方程式
(3)检验步骤④中加入的稀硫酸是否足量的方法是
(4)指出如图2的过滤操作的错误
(5)若实验过程中的物质损失忽略,最终所得硫酸锌的质量
查看习题详情和答案>>

试回答:
(1)步骤①中锌粉必须过量的原因是
将废液中的Cu2+和Fe2+全部置换出来
将废液中的Cu2+和Fe2+全部置换出来
;(2)写出步骤①中任一反应的化学方程式
Zn+CuSO4=ZnSO4+Cu或Zn+FeSO4═ZnSO4+Fe
Zn+CuSO4=ZnSO4+Cu或Zn+FeSO4═ZnSO4+Fe
;(3)检验步骤④中加入的稀硫酸是否足量的方法是
继续加入少量稀硫酸,观察是否有气泡产生
继续加入少量稀硫酸,观察是否有气泡产生
;(4)指出如图2的过滤操作的错误
没用玻璃棒引流、滤纸边缘高于漏斗口
没用玻璃棒引流、滤纸边缘高于漏斗口
;在蒸发滤液A的过程中,用玻璃棒不断搅拌的作用使液体均匀受热,防止飞溅
使液体均匀受热,防止飞溅
;(5)若实验过程中的物质损失忽略,最终所得硫酸锌的质量
大于
大于
(填“大于”、“小于”或“等于”)原废液中硫酸锌的质量.要计算该废液中硫酸铜质量,必须要称量固体D或铜
固体D或铜
的质量.某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如下实验方案:
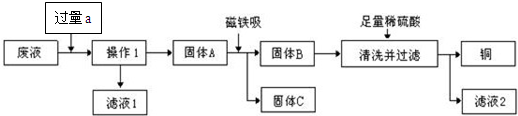
试回答:
(1)操作1是
(2)加入物质a必须过量的原因是
(3)要检验加入的稀硫酸是否足量的方法是
(4)若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量
查看习题详情和答案>>

试回答:
(1)操作1是
过滤
过滤
,固体A的成分Cu、Zn、Fe
Cu、Zn、Fe
,固体C是铁粉
铁粉
,滤液1和滤液2中溶质相同,该溶质是ZnSO4
ZnSO4
.(2)加入物质a必须过量的原因是
将废液中的Cu2+和Fe2+全部置换出来
将废液中的Cu2+和Fe2+全部置换出来
.(3)要检验加入的稀硫酸是否足量的方法是
取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生,则酸不足量(或若无气泡产生,则酸已足量)
取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生,则酸不足量(或若无气泡产生,则酸已足量)
.(4)若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量
>
>
(填“>”、“<”或“=”)原废液中硫酸锌的质量.要计算该废液中硫酸铜质量,必须要称量固体D(或铜)
固体D(或铜)
的质量.(2012?玄武区二模)金属在工农业生产和日常生活中有着很重要的作用.
(1)不锈钢属于
(2)铝制品具有很好的抗腐蚀性能,现在世界上铝的年产量已超过了铜.请将方框内横线上的正确答案填写在答题纸上.
(3)某同学实验结束时,为了回收含有CuSO4、ZnSO4、FeSO4废液中的有关金属和盐,设计了如下实验方案:
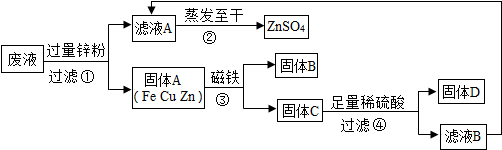
试回答:
Ⅰ.步骤①中锌粉必须过量的原因是
Ⅱ.写出步骤①中任一反应的化学方程式
Ⅲ.要检验步骤④中加入的稀硫酸是否足量的方法
Ⅳ.若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量
查看习题详情和答案>>
(1)不锈钢属于
混合物
混合物
(填“纯净物”、“混合物”).(2)铝制品具有很好的抗腐蚀性能,现在世界上铝的年产量已超过了铜.请将方框内横线上的正确答案填写在答题纸上.

(3)某同学实验结束时,为了回收含有CuSO4、ZnSO4、FeSO4废液中的有关金属和盐,设计了如下实验方案:

试回答:
Ⅰ.步骤①中锌粉必须过量的原因是
将废液中的Cu2+和Fe2+全部置换出来
将废液中的Cu2+和Fe2+全部置换出来
.Ⅱ.写出步骤①中任一反应的化学方程式
Zn+CuSO4=ZnSO4+Cu
Zn+CuSO4=ZnSO4+Cu
.Ⅲ.要检验步骤④中加入的稀硫酸是否足量的方法
取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生,则酸不足量
取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生,则酸不足量
.Ⅳ.若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量
>
>
(填“>”、“<”或“=”)原废液中硫酸锌的质量.要计算该废液中硫酸铜质量,必须要称量固体D(或铜)
固体D(或铜)
的质量.