网址:http://m.1010jiajiao.com/timu3_id_323892[举报]
[化学—选修物质结构和性质](15分)有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2∶1。请回答下列问题:
(1)A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于 (填写“六方”、“面心立方”或“体心立方”)。
(2)B-的电子排布式为 ,在CB3分子中C元素原子的原子轨道发生的是 杂化。
(3)C的氢化物的空间构型为 ,其氢化物在同族元素所形成的氢化物中沸点最高的原因是 。
(4)B元素的电负性 D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱: 。
(5)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。试计算R晶体的密度为 。(阿伏加德罗常数用NA表示)
[化学—选修物质结构和性质](15分)有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2∶1。请回答下列问题:
(1)A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于 (填写“六方”、“面心立方”或“体心立方”)。
(2)B-的电子排布式为 ,在CB3分子中C元素原子的原子轨道发生的是 杂化。
(3)C的氢化物的空间构型为 ,其氢化物在同族元素所形成的氢化物中沸点最高的原因是 。
(4)B元素的电负性 D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱: 。
(5)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。试计算R晶体的密度为 。(阿伏加德罗常数用NA表示)
查看习题详情和答案>>
(1)A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于 (填写“六方”、“面心立方”或“体心立方”)。
(2)B-的电子排布式为 ,在CB3分子中C元素原子的原子轨道发生的是 杂化。
(3)C的氢化物的空间构型为 ,其氢化物在同族元素所形成的氢化物中沸点最高的原因是 。
(4)B元素的电负性 D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱: 。
(5)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。试计算R晶体的密度为 。(阿伏加德罗常数用NA表示)

有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数。R是由A、D两元素形成的离子化合物,其中A+与D2一离子数之比为2:1。请回答下列问题:
(1)A元素形成的晶体内晶体类型应属于 (填写“六方”、“面心立方”或“体心立方”)堆积,空间利用率为 。
(2)C3-的电子排布式为 ,在CB3分子中C元素原子的原子轨道发生的是 杂化,CB3分子的VSEPR模型为 。
(3)C的氢化物在水中的溶解度如何 ,为什么具有这样的溶解性 。
(4)D元素与同周期相邻元素的第一电离能由大到小的关系是:
(用元素符号表示);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱: 。
(5)如图所示是R形成的晶体的晶胞,该晶胞与CaF2晶胞结构相似,设晶体密度是p g·cm-3试计算R晶体中A+和D2-最短的距离 。
(阿伏加德罗常数用NA表示,只写出计算式,不用计算)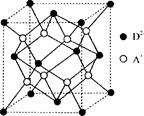
(1)A元素形成的晶体内晶体类型应属于 (填写“六方”、“面心立方”或“体心立方”)堆积,空间利用率为 。
(2)C3-的电子排布式为 ,在CB3分子中C元素原子的原子轨道发生的是 杂化,CB3分子的VSEPR模型为 。
(3)C的氢化物在水中的溶解度如何 ,为什么具有这样的溶解性 。
(4)D元素与同周期相邻元素的第一电离能由大到小的关系是:
(用元素符号表示);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱: 。
(5)如图所示是R形成的晶体的晶胞,该晶胞与CaF2晶胞结构相似,设晶体密度是p g·cm-3试计算R晶体中A+和D2-最短的距离 。
(阿伏加德罗常数用NA表示,只写出计算式,不用计算)
