题目内容
[化学—选修物质结构和性质](15分)有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2∶1。请回答下列问题:
(1)A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于 (填写“六方”、“面心立方”或“体心立方”)。
(2)B-的电子排布式为 ,在CB3分子中C元素原子的原子轨道发生的是 杂化。
(3)C的氢化物的空间构型为 ,其氢化物在同族元素所形成的氢化物中沸点最高的原因是 。
(4)B元素的电负性 D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱: 。
(5)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。试计算R晶体的密度为 。(阿伏加德罗常数用NA表示)
(1)A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于 (填写“六方”、“面心立方”或“体心立方”)。
(2)B-的电子排布式为 ,在CB3分子中C元素原子的原子轨道发生的是 杂化。
(3)C的氢化物的空间构型为 ,其氢化物在同族元素所形成的氢化物中沸点最高的原因是 。
(4)B元素的电负性 D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱: 。
(5)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。试计算R晶体的密度为 。(阿伏加德罗常数用NA表示)

26.(1)体心立方(2)ls22s22p63s23p6,sp3(3)三角锥形;氨分子间形成氢键,所以氨气比同族其它元素形成的氢化物沸点高(4)>;H2S+Cl2=2HCl+S↓ (5)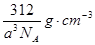
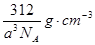
试题分析:根据题目信息可知A为钠B为氯,C为氮D为硫.
1、钠形成的晶体属于体心立方,
2、氯离子有18个电子,可以写出其电子排布式为ls22s22p63s23p6,CB3分子为三氯化氮分子,C元素原子的原子轨道发生的是sp3
3、氮的氢化物为氨气,由于氨分子之间能形成氢键,所以氨气比同族其他元素形成的氢化物沸点高。
4、氯的电负性大于硫的,因为H2S+Cl2=2HCl+S↓
5、晶体的晶胞结构图可知, 1个晶胞中由4个硫化钠,由V= m/ρ可知,V为a的三次方,即可计算出晶胞的密度。
点评:本题考查原子结构与物质的性质,题目难度较大,元素的推断是解答本题的关键,注重对化学键、晶胞结构等高考常考查点的考查.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目


 C中的阴离子主要是_
C中的阴离子主要是_
 ,反应中若形成
,反应中若形成 键放热103.9k!。则该反应的
键放热103.9k!。则该反应的 =_______。
=_______。