摘要:14.今测得某次酸雨中离子浓度大小为:c(NH4+)=2.0×10-5mol/L.c(Cl-)= 6.0×10-5mol/L.c(SO42-)= 2.8×10-5mol/L.c(NO3-)= 2.3×10-5mol/L.c(Na+)=1.9×10-5mol/L.则此次酸雨中c(H+)约为 A.1.0×10-3mol/L B.1.0×10-4mol/L C.1.0×10-5mol/L D.1.0×10-6mol/L
网址:http://m.1010jiajiao.com/timu3_id_323596[举报]
制造普通玻璃的原料是纯碱(Na2CO3)、石灰石(CaCO3)和石英(SiO2),这种玻璃的成分可以认为是由Na2O、CaO和SiO2所组成的混合物,而钾玻璃是将原料中的Na2CO3由K2CO3替代而制得的.今测得某钾玻璃中各成分的质量分数为:18.4%的K2O、11.0%的CaO和70.6%的SiO2.求生产制取这种钾玻璃的原料的物质的量之比是多少?
制造普通玻璃的原料是纯碱(Na2CO3)、石灰石(CaCO3)和石英(SiO2),这种玻璃的成分可以认为是由Na2O、CaO和SiO2所组成的混合物,而钾玻璃是将原料中的Na2CO3由K2CO3替代而制得的。今测得某钾玻璃中各成分的质量分数为:18.4%的K2O、11.0%的CaO和70.6%的SiO2。求生产制取这种钾玻璃的原料的物质的量之比是多少?
查看习题详情和答案>>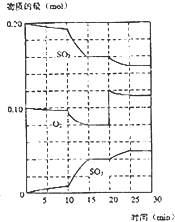 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0(1)写出该反应的化学平衡常数表达式K=
| [SO3]2 |
| [SO2]2[O2] |
| [SO3]2 |
| [SO2]2[O2] |
(2)降低温度,该反应K值
增大
增大
(填“增大、减小或不变”)(3)在600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是
15-20min
15-20min
和25-30min.(4)在第一次平衡状态时,SO2的转化率是
20%
20%
.(5)在600℃时,测得某混合体系中各物质的浓度为:c(SO2)=0.1mol/L,c(O2)=0.5mol/L,c(SO3)=0.2mol/L.通过计算,判断此混合体系中反应进行的方向.要求写出具体的计算过程.