网址:http://m.1010jiajiao.com/timu3_id_322131[举报]
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中,与D形成的化合物是生活中最常用的调味品 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A元素在周期表中的位置为
(2)A、D的氢化物相互反应,产生白色固体,写出该反应的化学方程式
(3)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)若在D与E组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图所示,其反应中正极出现的现象是

(1)元素E位于周期表中第
(2)D2C2的电子式为




(3)B的氢化物与B的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为
| ||
| ||
(4)B的最高价氧化物的水化物(浓溶液) 跟铜反应的离子方程式:
(5)化合物EC2通入到BaCl2和H2O2的混合溶液,生成白色沉淀,有关反应的离子方程式为
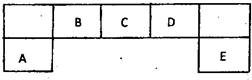 短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,其中B元素形成的化合物在自然界中的种类最多.请回答下列问题
短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,其中B元素形成的化合物在自然界中的种类最多.请回答下列问题(1)描述D在元素周期表中的位置:
(2)比较A、C、D元素简单离子半径的大小:
(3)F与D同主族且相邻,请说出D的氢化物比F的氢化物稳定的根本原因:
(4)C的氢化物与其最高价氧化物对应的水化物反应,产物溶于水呈
(5)D原子与氢原子可形成10电子阳离子,写出该阳离子的电子式


(6)E的最高价氧化物的水化物的化学式为
| ||
| ||
(1)Y在元素周期表中的位置是
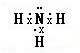
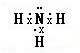
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈
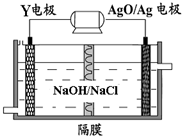
(3)Y-AgO电池是应用广泛的鱼雷电池,其原理如图所示.该电池的负极反应式是
(4)Z和W比较,非金属性较弱的是
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1mol H-Z或H-W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性.
锶(Sr)位于元素周期表的第5周期IIA族。碳酸锶(SrCO3)是一种重要的无机产品:被广泛用于彩色电视机的阴极射线管。以天青石和碳酸钠溶液混合浸泡制取碳酸锶的离子方程式是:SrSO4十CO32- SrCO3 +SO42-,△H
请回答下列问题:
(1)下列关于锶及其化合物的叙述中,错误的是___________。
A.锶比钙的金属性强,单质能和水反应放出氢气
B.氢氢化锶呈两性
C.SrCO3难溶于水
D.锶在化合物中呈十2价
(2)当温度升高,上述反应速率增大,但硫酸锶的转化率降低,则说明上述反应的△H__________0 (填“>”、“<”或“==:”)
(3)写出上述反应平衡常数的表达式:K=___________;
若已知Ksp(SrSO4)=3×10-7,Ksp(SrCO3)= 1×10-10,
则该反应的平衡常数的数值是____________;
泉州市质检理综 第10页(共14页)
(4)如果将Na2CO3换成(NH4)2CO3,SrCO3的产率将降低,这与Na2CO3溶液和
(NH4)2CO3溶液的pH有关,当两者浓度、温度均相同时,Na2CO3溶液的pH
____________(填“>”、“<”或“=”)(NH4)2CO3溶液的pH;
(5)另一种以天青石为原料制备碳酸锶的方法是:将天青石粉碎后在1000℃
~1200℃时与碳反应制得可溶性的硫化锶,再由硫化锶经一系列反应制碳酸锶。其中发生的化学反应有:4C(s)+SrSO4(s)=SrS(s) +4CO(g),△H1;SrS(s)+2O2(g)=SrSO4(s),△H2;2C(s)+O2(g) == 2CO(g),△H3;已知:
△H2 = akJ?mol-1。;△H 3 = b kJ?mol-1
则△H1__________(用含a和b的代数式表示)
查看习题详情和答案>>