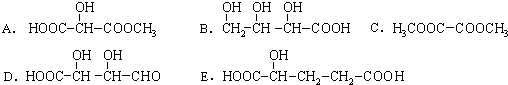摘要:C 2.C 3.D
网址:http://m.1010jiajiao.com/timu3_id_321508[举报]
C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质.D的最外层电子数是次外层电子数的3倍,C、G同周期,且最外层电子数相差4,它们的简单离子电子层结构不同.相互间有如下转化关系:
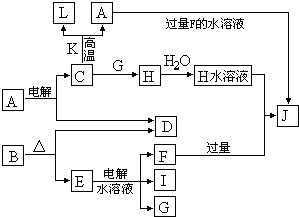
请填空:
(1)D与I能形成原子个数比为1:1的共价化合物,请写出其分子式:
G与I也能形成原子个数比为1:1的共价化合物,请写出其电子式: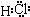
 .
.
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解1L1mol?L-1的E水溶液的化学方程式:
(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%.反应C→L的化学方程式是
(4)写出A+F→J的离子方程式:
查看习题详情和答案>>

请填空:
(1)D与I能形成原子个数比为1:1的共价化合物,请写出其分子式:
H2O2
H2O2
;G与I也能形成原子个数比为1:1的共价化合物,请写出其电子式:
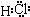
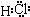
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解1L1mol?L-1的E水溶液的化学方程式:
2KCl+2H2O
2KOH+Cl2↑+H2↑
| ||
2KCl+2H2O
2KOH+Cl2↑+H2↑
,当溶液的pH=13时,理论上生成G的单质在标准状况下的体积为
| ||
1.12L
1.12L
;若将上述两电极材料调换,则阳极上的电极反应为Fe-2e-=Fe2+
Fe-2e-=Fe2+
.(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%.反应C→L的化学方程式是
Fe2O3+2Al
Al2O3+2Fe
| ||
Fe2O3+2Al
Al2O3+2Fe
| ||
(4)写出A+F→J的离子方程式:
Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.D、A、B、C为四种原子序数依次增大的短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.已知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.
(1)C元素在周期表中的位置
(2)A、B元素形成的常见化合物水溶液显
(3)A、D元素可以形成化合物A2D2,写出A2D2与CO2反应的化学方程式
(4)B元素的单质在不同的条件下可以与O2发生一系列反应:
B(s)+O2(g)=BO2(g);△H=-296.8kJ?mol-1
2BO2(g)+O2(g)?2BO3(g);△H=-196.6kJ?mol-1
则1mol BO3(g)若完全分解成B(s),反应过程中的热效应为
查看习题详情和答案>>
(1)C元素在周期表中的位置
第三周期
第三周期
周期VIIA
VIIA
族.(2)A、B元素形成的常见化合物水溶液显
碱性
碱性
性,原因是(用离子方程式表示)S2-+H2O?HS-+OH-
S2-+H2O?HS-+OH-
;用石墨做电极电解该化合物的水溶液,则阴极反应式为2H++2e-=H2↑
2H++2e-=H2↑
,(3)A、D元素可以形成化合物A2D2,写出A2D2与CO2反应的化学方程式
2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2CO2═2Na2CO3+O2
(用元素符号表示).该反应中还原剂是Na2O2
Na2O2
.(4)B元素的单质在不同的条件下可以与O2发生一系列反应:
B(s)+O2(g)=BO2(g);△H=-296.8kJ?mol-1
2BO2(g)+O2(g)?2BO3(g);△H=-196.6kJ?mol-1
则1mol BO3(g)若完全分解成B(s),反应过程中的热效应为
吸收395.1kJ热量(或+395.1kJ)
吸收395.1kJ热量(或+395.1kJ)
. .
.