网址:http://m.1010jiajiao.com/timu3_id_320994[举报]
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)===Na2CO3(s)+1/2O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
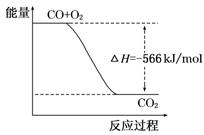
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO2(s)+O2(g) ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看习题详情和答案>>
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+1/2O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
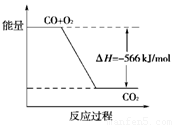
A.CO的燃烧热为283kJ
B.上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g)ΔH>-452 kJ·mol-1
D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023
查看习题详情和答案>>
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+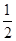 O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法错误的是
| A.CO的燃烧热为283 kJ/mol |
B.下图可表示由CO生成CO2的反应过程和能量关系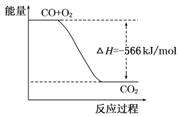 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023 |
Na2O2(s)+CO2(g)=Na2CO3(s)+
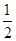 O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol根据以上热化学方程式判断,下列说法错误的是
| A.CO的燃烧热为283 kJ/mol |
B.下图可表示由CO生成CO2的反应过程和能量关系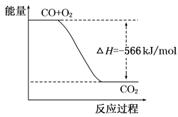 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023 |
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+1/2O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )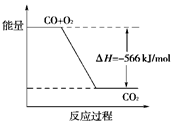
| A.CO的燃烧热为283kJ |
| B.上图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g)ΔH>-452 kJ·mol-1 |
| D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023 |