网址:http://m.1010jiajiao.com/timu3_id_320651[举报]

(1)最初混合溶液中H2SO4和盐酸的物质的量浓度;
(2)当加入Ba(OH)2体积分别为20mL和40mL时,溶液的pH各为多少?(1g5=0.69,lg6=0.78)
@维生素C是一种水溶性维生素(pH<7),化学式为C6H8O6,人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸。它易被空气中的O2氧化,在新鲜的水果、蔬菜、乳制品中都富含维生素C,如新鲜橙汁中含量在500mg×L-1左右。校外活动小组测定了某牌子的橙汁中维生素C的含量,下面是实验报告单,请填写。
(1)测定目的:测定××牌橙汁维生素C的含量
(2)测定原理:C6H8O6+Ⅰ2![]() C6H6O6+2H++2I-
C6H6O6+2H++2I-
(3)实验用品及试剂:
①仪器和用品:自选(略)
②试剂:指示剂________(填名称),7.50´10-3mol×L-1标准碘溶液、蒸馏水等。
(4)实验过程:
①洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用。
②打开橙汁包装,目测:颜色——橙黄色,澄清度——好。用________(填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
③用左手控制滴定管的________(填部位),右手摇动锥形瓶,眼睛注视________直到滴定终点。滴定至终点的现象是________。
(5)数据记录与处理。(设计数据记录和数据处理的表格,不必填数据)若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是________mg×L-1。
(6)问题讨论:
①滴定时能否剧烈摇动锥形瓶?为什么?答:____________________。
②从分析数据看,此软包装橙汁是不是纯天然橙汁?答:______(填编号)
|
A.是 |
B.可能是 |
C.不是 |
制造商可能采取的做法是______。
|
A.加水稀释天然橙汁 |
B.橙汁已被浓缩 |
C.将维生素C作为添加剂 |
对于上述做法,你的意见是______。
|
A.同意 |
B.不同意 |
C.调查后再作结论 |
查看习题详情和答案>>
有H2SO4和HCl的混合溶液20mL,在这个溶液中加入0.025mol×L-1的Ba(OH)2溶液,生成的BaSO4的量和相对应的溶液的pH如图所示,求解下列问题(保留两位有效数字)。

(1)最初混合溶液中H2SO4和盐酸的物质的量浓度;
(2)当加入Ba(OH)2体积分别为20mL和40mL时,溶液的pH各为多少?(1g5=0.69,lg6=0.78)
@维生素C是一种水溶性维生素(pH<7),化学式为C6H8O6,人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸。它易被空气中的O2氧化,在新鲜的水果、蔬菜、乳制品中都富含维生素C,如新鲜橙汁中含量在500mg×L-1左右。校外活动小组测定了某牌子的橙汁中维生素C的含量,下面是实验报告单,请填写。
(1)测定目的:测定××牌橙汁维生素C的含量
(2)测定原理:C6H8O6+Ⅰ2![]() C6H6O6+2H++2I-
C6H6O6+2H++2I-
(3)实验用品及试剂:
①仪器和用品:自选(略)
②试剂:指示剂________(填名称),7.50´10-3mol×L-1标准碘溶液、蒸馏水等。
(4)实验过程:
①洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用。
②打开橙汁包装,目测:颜色——橙黄色,澄清度——好。用________(填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
③用左手控制滴定管的________(填部位),右手摇动锥形瓶,眼睛注视________直到滴定终点。滴定至终点的现象是________。
(5)数据记录与处理。(设计数据记录和数据处理的表格,不必填数据)若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是________mg×L-1。
(6)问题讨论:
①滴定时能否剧烈摇动锥形瓶?为什么?答:____________________。
②从分析数据看,此软包装橙汁是不是纯天然橙汁?答:______(填编号)
|
A.是 |
B.可能是 |
C.不是 |
制造商可能采取的做法是______。
|
A.加水稀释天然橙汁 |
B.橙汁已被浓缩 |
C.将维生素C作为添加剂 |
对于上述做法,你的意见是______。
|
A.同意 |
B.不同意 |
C.调查后再作结论 |
查看习题详情和答案>>
 H2(g)+CO2(g) △H=-41.2kJ/mol ,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g) △H=-41.2kJ/mol ,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。(1)已知:850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图1所示:

A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.第4min始,混合气体的平均相对分子质量不再变化
D.第6min时,若升高温度,反应平衡常数会减小
E.第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
(2) 850 ℃时,若在容积为2 L的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2。若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
(3)研究小组采用碱液吸收一定量CO2的方法来提高混合气中H2与CO2的体积比。若以1L 1.5mol/L的NaOH溶液充分吸收了22.4L(已折算为标准状况下体积)CO2,则吸收后溶液中各离子浓度从大到小的顺序是________________。
(4) 如将H2 与CO2以4:1的体积比混合,在适当的条件下可制得CH4。
已知:CH4(g) + 2O2(g)
 CO2(g)+ 2H2O(l) ΔH1=-890.3 kJ/mol
CO2(g)+ 2H2O(l) ΔH1=-890.3 kJ/mol H2(g) + 1/2O2(g)
 H2O(l) ΔH2=-285.8 kJ/mol
H2O(l) ΔH2=-285.8 kJ/mol 则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是__________________。
(5) 熔融盐燃料电池(见图2)是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 +4CO32--8e-=5CO2+2H2O。正极的电极反应是________。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环,则A物质的化学式是_________。实验过程中,若通入了标准状况下空气448 L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH4____________L。
A.蒸馏;B.盐析;C.过滤;D.重结晶;E、升华;F、渗析;G、电解;H、加热分解;I.洗气.如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
(1)除去淀粉溶液中的少量碘化钠
(2)从油脂皂化反应后的混合液中分离出高级脂肪酸钠
(3)除去粗铜中锌、银等金属
(4)除去水中的Na+、SO42-、Cl-等杂质
(5)除去KNO3晶体中混有的少量NaCl
II.某学生完成硫酸铜晶体结晶水含量测定实验得到以下数据:
| 加热前质量 | 加热前质量 | 加热后质量 |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
| 160(W2-W3) |
| 18(W3-W1) |
| 160(W2-W3) |
| 18(W3-W1) |
III.50mL0.50mol?L-1盐酸和50mL 0.55mol?L-1烧碱溶液进行中和反应,若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①2.3℃②2.4℃③2.9℃,则△H=
| 0.418×2.35 |
| 0.025 |
| 0.418×2.35 |
| 0.025 |
I.可用于分离或提纯物质的方法有:
A.蒸馏;B.盐析;C.过滤;D.重结晶;E、升华;F、渗析;G、电解;H、加热分解;I.洗气.如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
(1)除去淀粉溶液中的少量碘化钠______;
(2)从油脂皂化反应后的混合液中分离出高级脂肪酸钠______;
(3)除去粗铜中锌、银等金属______;
(4)除去水中的Na+、S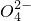 、Cl-等杂质______;
、Cl-等杂质______;
(5)除去KNO3晶体中混有的少量NaCl______.
II.某学生完成硫酸铜晶体结晶水含量测定实验得到以下数据:
| 加热前质量 | 加热前质量 | 加热后质量 |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
III.50mL0.50mol?L-1盐酸和50mL 0.55mol?L-1烧碱溶液进行中和反应,若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①2.3℃②2.4℃③2.9℃,则△H=______KJ/mol(填数学计算式).[反应后混合液的比热容为4.18J/(g?℃)]. 查看习题详情和答案>>