网址:http://m.1010jiajiao.com/timu3_id_320454[举报]
用一定浓度的稀盐酸与稀NaOH溶液在下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.已知强酸与强碱的中和热为57.3 KJ/mol,水的比热容为4.2 J/(g·℃),有关热量与比热容的计算公式∶Q=m×c×Δt(Q为热量,m为物质的质量,c为比热容,Δt物质温度的变化值)
回答下列问题∶
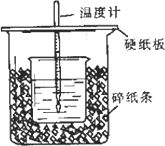
(1)从实验装置上看,图中尚缺少的一种玻璃用品是∶________
(2)将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL).
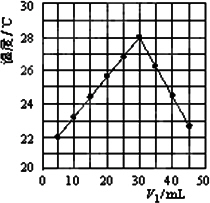
下列叙述正确的是________
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol/L
D.该实验表明有水生成的反应都是放热反应
(3)V1=30 mL时HCl和NaOH恰好反应,根据题中所给数据算出的温度变化值约为________(保留整数,计算时可将稀溶液的密度及比热容看成与水近似相同,且溶液混合时体积变化忽略不计);而根据上图的温度变化可读出温度变化值约7℃;两者相比所测结果偏低,造成如此现象的原因有∶________
| A、稀释pH=10的氨水,溶液中所有离子的浓度均降低 | B、相同体积、相同浓度的盐酸与醋酸溶液,分别与同浓度的氢氧化钠溶液恰好完全反应时,醋酸消耗的氢氧化钠溶液体积多 | C、pH=11的NaOH溶液和pH=11的氨水分别稀释100倍后的pH前者一定小于后者 | D、分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
常温时,下列关于电解质溶液的叙述正确的是 ( )
A.稀释pH=10的氨水,溶液中所有离子的浓度均降低
B.相同体积、相同浓度的盐酸与醋酸溶液,分别与同浓度的氢氧化钠溶液恰好完全反应时,醋酸消耗的氢氧化钠溶液体积多
C.pH=11的NaOH溶液和pH=11的氨水分别稀释100倍后的pH前者一定小于后者
D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多
查看习题详情和答案>>