摘要:⑴金属与酸:Zn+H2SO4 = ZnSO4+H2↑, Zn+2HCl = ZnCl2+H2↑ Mg+H2SO4 = MgSO4+H2↑, Mg+2HCl = MgCl2+H2↑ Fe+H2SO4 = FeSO4+H2↑, Fe+2HCl = FeCl2+H2↑ 2Al+3H2SO4 = Al2(SO4)3+3H2↑, 2Al+6HCl = 2AlCl3+3H2↑ ⑵铁与硫酸铜:Fe+CuSO4 = FeSO4+Cu ⑶氢气或碳做还原剂:H2 + CuO △ Cu + H2O, 3H2+Fe2O3 高温 2Fe+3H2O C+2CuO 高温 2Cu+CO2↑, 3C+2Fe2O3 高温 4Fe+3CO2↑
网址:http://m.1010jiajiao.com/timu3_id_31760[举报]
(2007?漳州)某化学兴趣小组对Zn、Ti(钛)、Ag三种金属的活动性进行探究.
[提出假设]a:Zn金属活动性比Ti强b:Ag金属活动性比Ti强
[查阅资料]
(1)相同条件下,金属与酸反应,产生气泡的速率越快,则该金属活动性越强.
(2)比较活泼的金属能把比较不活泼的金属从其盐溶液中置换出来.
[进行实验]
(1)先用砂纸将三种金属的表面擦光亮.
(2)将大小厚薄相同的三种金属片分别放入等浓度等体积足量的稀盐酸中反应,观察现象.
[解释与结论]完成下表中有关现象和结论:
[拓展应用]
(1)感光材料经定影后,:材料中的银大部分进入废定影液中,废定影液中银的回收方法之一是金属置换法.请写出金属锌与废定影液中硝酸银(AgNO3)反应的化学方程式:
(2)非金属单质也具有类似金属与盐溶液之间置换反应的规律.已知几种非金属单质活动性顺序是:Cl2>Br2>I2>S.根据上述信息判断下列化学方程式书写错误的是
A.Cl2+2NaBr═2NaCl+Br2 B.I2+2KBr═2KI+Br2
C.Br2+2KI═2KBr+I2 D.I2+Na2S═2NaI+S.
查看习题详情和答案>>
[提出假设]a:Zn金属活动性比Ti强b:Ag金属活动性比Ti强
[查阅资料]
(1)相同条件下,金属与酸反应,产生气泡的速率越快,则该金属活动性越强.
(2)比较活泼的金属能把比较不活泼的金属从其盐溶液中置换出来.
[进行实验]
(1)先用砂纸将三种金属的表面擦光亮.
(2)将大小厚薄相同的三种金属片分别放入等浓度等体积足量的稀盐酸中反应,观察现象.
[解释与结论]完成下表中有关现象和结论:
| Zn | Ti | ag | |
| 与盐酸反应现象 | 放出气泡速率较快 | 放出气泡速率较慢 | |
| 结论 | (1)假设中 正确的(填“a”“b”,理由是 与盐酸反应锌放出气泡的速率比钛快,而银不与酸反应 与盐酸反应锌放出气泡的速率比钛快,而银不与酸反应 (2)三种金属的活动性有强到弱的顺序是 Zn>Ti>Ag Zn>Ti>Ag | ||
(1)感光材料经定影后,:材料中的银大部分进入废定影液中,废定影液中银的回收方法之一是金属置换法.请写出金属锌与废定影液中硝酸银(AgNO3)反应的化学方程式:
2AgNO3+Zn═Zn(NO3)2+2Ag
2AgNO3+Zn═Zn(NO3)2+2Ag
.(2)非金属单质也具有类似金属与盐溶液之间置换反应的规律.已知几种非金属单质活动性顺序是:Cl2>Br2>I2>S.根据上述信息判断下列化学方程式书写错误的是
B
B
(填标号).A.Cl2+2NaBr═2NaCl+Br2 B.I2+2KBr═2KI+Br2
C.Br2+2KI═2KBr+I2 D.I2+Na2S═2NaI+S.
23、小明同学学习了“酸的性质”、“金属”等知识后,对“酸与金属反应”的性质从内容、规律及其应用等方面进行了总结,请你协助小明同学完成相关总结材料
(1)酸与金属之间反应规律的文字表达式
(2)金属与酸之间的反应规律是
请你用元素符号填写金属活动性顺序
(3)金属与盐之间能否发生置换反应取决于参加反应的
查看习题详情和答案>>
(1)酸与金属之间反应规律的文字表达式
金属+酸→盐+氢气
(2)金属与酸之间的反应规律是
在金属活动性顺序表中,排在氢前面的金属可以置换出酸溶液里的氢
请你用元素符号填写金属活动性顺序
K Ca Na Mg A1 Zn Fe Sn Pb (H) Cu Hg Ag Pt Au(金属活动顺序由强逐渐减弱)
.(3)金属与盐之间能否发生置换反应取决于参加反应的
金属活动性
和盐的溶解性
,其反应规律是在金属活动性顺序里,排在前面的金属可以把排在后面的金属从其盐溶液里置换出来.(K Ca Na除外)
,该性质的实际应用实例是湿法冶金
. (2005?白下区一模)某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相等的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况如右图所示.下列对该图象理解的叙述中,正确的是( )
(2005?白下区一模)某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相等的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况如右图所示.下列对该图象理解的叙述中,正确的是( )[相对原子质量Mg-24 Zn-65 Fe-56 Al-27 Na-23].
查看习题详情和答案>>
(2013?贵阳)化学实验是学习化学的重要方法.请完成下列金属性质的实验.
(1)实验一:比较铁、铜的金属活动性强弱.请你设计实验完成下表内容.
(2)实验二:镁、锌、铁三种金属与酸的反应.
[实验]取一定量的镁、锌、铁三种金属分别加入到溶质质量分数相同的稀硫酸中,充分反应,观察现象.
[结论]活泼金属能与酸反应.
[分析]①三个反应的共同特点是
②若完全反应后,三个反应生成氢气的质量相等,原因是
查看习题详情和答案>>
(1)实验一:比较铁、铜的金属活动性强弱.请你设计实验完成下表内容.
| 实验步骤 | 实验现象 | 结 论 |
| 金属活动性:Fe>Cu |
[实验]取一定量的镁、锌、铁三种金属分别加入到溶质质量分数相同的稀硫酸中,充分反应,观察现象.
[结论]活泼金属能与酸反应.
[分析]①三个反应的共同特点是
都是置换反应
都是置换反应
,写出其中一个反应的化学方程式Mg+H2SO4=MgSO4+H2↑或Zn+H2SO4=ZnSO4+H2↑或Fe+H2SO4=FeSO4+H2↑
Mg+H2SO4=MgSO4+H2↑或Zn+H2SO4=ZnSO4+H2↑或Fe+H2SO4=FeSO4+H2↑
.②若完全反应后,三个反应生成氢气的质量相等,原因是
当三种金属过量,硫酸完全反应时,则生成氢气质量相等;当硫酸过量,三种金属完全反应,且质量比为mMg:mZn:mFe=24:65:56时,则生成氢气质量相等
当三种金属过量,硫酸完全反应时,则生成氢气质量相等;当硫酸过量,三种金属完全反应,且质量比为mMg:mZn:mFe=24:65:56时,则生成氢气质量相等
.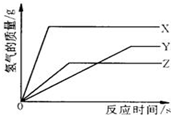 某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验,取等质量的X、Y、Z分别与足量的溶质质量分数相同的稀H2SO4反应,都生成+2价金属的硫酸盐,反应情况如图所示,下列对该图象理解的叙述中,正确的是( )
某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验,取等质量的X、Y、Z分别与足量的溶质质量分数相同的稀H2SO4反应,都生成+2价金属的硫酸盐,反应情况如图所示,下列对该图象理解的叙述中,正确的是( )