摘要:1mol/LNaCl溶液.pH=3的醋酸.(d)pH=10的氨水四种溶液. ①假设带相同电荷数的离子的导电能力相同.则溶液导电性强弱顺序为 ②四种溶液中水电离出的H+浓度最大的是 ③用pH试纸测量上述盐酸的pH时如果先用蒸馏水润湿试纸.则测量结果 (填“偏高 .“偏低 或“无影响 )
网址:http://m.1010jiajiao.com/timu3_id_315070[举报]
(8分)(1)A、B两元素均位于周期表中第三周期,它们的原子核外最外层电子数之和为7,其中A元素的原子核外最外层电子数为1个,两者间可形成化合物A2B。根据以上条件回答:
①写出A、B的元素符号:A ,B
②写出化合物A2B的电子式 。
(2) 现有A、B、C、D四种物质,它们之间能发生如下图所示的转化关系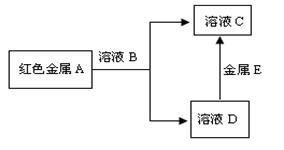
溶液B、C中都含有金属元素E,溶液B的颜色为黄色。请根据以上信息回答下列问题:
①写出金属E元素符号:
②写出金属A和溶液B反应的离子方程式:
③为了检验溶液B中金属阳离子,通常加入的试剂是
(8分) (1)A、B两元素均位于周期表中第三周期,它们的原子核外最外层电子数之和为7,其中A元素的原子核外最外层电子数为1个,两者间可形成化合物A2B。根据以上条件回答:
①写出A、B的元素符号:A ,B
②写出化合物A2B的电子式 。
(2) 现有A、B、C、D四种物质,它们之间能发生如下图所示的转化关系
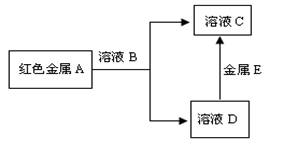
溶液B、C中都含有金属元素E,溶液B的颜色为黄色。请根据以上信息回答下列问题:
①写出金属E元素符号:
②写出金属A和溶液B反应的离子方程式:
③为了检验溶液B中金属阳离子,通常加入的试剂是
查看习题详情和答案>>
A、B、C、D、E五种透明溶液,分别是HCl、BaCl2、NaHSO4、K2CO3、AgNO3中的一种.现有如下实验结果:
①A 与B 反应有气体生成②A 与E 反应有气体生成③B 与C反应有沉淀生成④C 与D 反应有沉淀生成⑤D与E 反应有沉淀生成
已知:在③和④反应中生成的沉淀是同一种物质.请填空:
(1)在③和④的反应中,生成的沉淀的化学式是 .
(2)A是 ,C是 D是 .
(3)反应②的离子方程式是 .
查看习题详情和答案>>
①A 与B 反应有气体生成②A 与E 反应有气体生成③B 与C反应有沉淀生成④C 与D 反应有沉淀生成⑤D与E 反应有沉淀生成
已知:在③和④反应中生成的沉淀是同一种物质.请填空:
(1)在③和④的反应中,生成的沉淀的化学式是
(2)A是
(3)反应②的离子方程式是
已知A、B、C、D、E为五种短周期不同主族的元素,其原子序数依次递增.A、E两种原子最外层电子数之和是B原子最外层电子数的2倍;C、E两种原子最外层电子数之和是D原子最外层电子数的2倍.A、E形成的化合物甲分子中电子总数为18,D原子核外最外层电子排布式为nsnnpn+2.请回答下列问题
(1)B、C、D三种元素的第一电离能较大的是
(2)A单质与C单质在一定条件下可化合为乙,室温下,向pH=a的乙的水溶液中加入等体积pH=b的甲的水溶液,且a+b=14,充分作用后,溶液的pH
(3)A、B两元素也可形成多种化合物,其中相对分子质量最小的分子为丙.用D的单质和丙可以构成原电池,电池用多孔的惰性电极浸入浓KOH溶液,在X极通入化合物丙,Y极通入D的单质,则X极的电极反应式为
(4)工业生产E元素单质的化学方程式为
(5)常温常压下,由A、B、D可组成液态物质J.现有2.3gJ与足量的D的单质充分反应,生成标准状况下2.24L BD2气体和2.7gA2D液体,同时放出68.35kJ的热量,该反应的热化学方程式为
查看习题详情和答案>>
(1)B、C、D三种元素的第一电离能较大的是
N
N
(填写元素符号)(2)A单质与C单质在一定条件下可化合为乙,室温下,向pH=a的乙的水溶液中加入等体积pH=b的甲的水溶液,且a+b=14,充分作用后,溶液的pH
>
>
7(填“>”“<”或“=”),该溶液中各种离子浓度由大到小的顺序为c(NH4+)>C(Cl-)>c(OH-)>c(H+)
c(NH4+)>C(Cl-)>c(OH-)>c(H+)
.(3)A、B两元素也可形成多种化合物,其中相对分子质量最小的分子为丙.用D的单质和丙可以构成原电池,电池用多孔的惰性电极浸入浓KOH溶液,在X极通入化合物丙,Y极通入D的单质,则X极的电极反应式为
CH4-8e-+10OH-=CO32-+7H20
CH4-8e-+10OH-=CO32-+7H20
.(4)工业生产E元素单质的化学方程式为
2NaCl+2H20
2NaOH+Cl2↑+H2↑
| ||
2NaCl+2H20
2NaOH+Cl2↑+H2↑
.
| ||
(5)常温常压下,由A、B、D可组成液态物质J.现有2.3gJ与足量的D的单质充分反应,生成标准状况下2.24L BD2气体和2.7gA2D液体,同时放出68.35kJ的热量,该反应的热化学方程式为
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367KJ/mol
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367KJ/mol
.现有四瓶丢失标签的NaOH、Na2CO3、A1C13. NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验.实验过程和记录如图所示(无关物质已经略去):请回答:
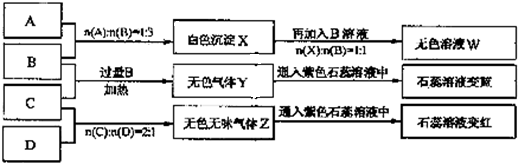
(1)写出各瓶溶液的化学式:A
(2)A、W的溶液分别加热蒸干并灼烧最后所得固体为
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是
(4)等物质的量浓度的C溶液与NH4Cl溶液相比较,c(NH4+):前者
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是
查看习题详情和答案>>

(1)写出各瓶溶液的化学式:A
AlCl3
AlCl3
BNaOH
NaOH
CNH4HSO4
NH4HSO4
DNa2CO3
Na2CO3
;(2)A、W的溶液分别加热蒸干并灼烧最后所得固体为
Al2O3
Al2O3
、NaAlO2
NaAlO2
(填化学式).D溶液pH大于
大于
7(填“大于”、“小于”或“等于”),原因是(请用离子方程式表示):CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
.(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是
B>D>A>C
B>D>A>C
.(用字母表示)(4)等物质的量浓度的C溶液与NH4Cl溶液相比较,c(NH4+):前者
>
>
后者(填“<、>”或“=”).(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是
c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-)
c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-)
.