摘要:按物质的量之比为1∶4在定容容器中充入N2和H2.一段时间后反应达到了平衡.N2和H2的物质的量之比为1∶5.计算:(1)平衡混合气中NH3的体积分数,(2)平衡混合气的平均摩尔质量,(3)平衡时气体的压强与起始时压强之比.
网址:http://m.1010jiajiao.com/timu3_id_315051[举报]
右边框图中的物质是中学化学中常见的物质,已知B、E在常温下为气态,其余均为固体,其中D是一种淡黄色固体。试根据框图和所学知识回答下列问题:
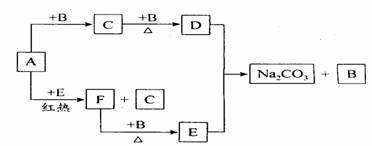
(1)写出D的化学式和E的电子式:D的化学式 、E的电子式 。
(2)A+E→C+F的反应方程式为 。
(3)往饱和Na2CO3溶液中不断通入E气体,会看到溶液变浑浊(有白色固体析出),写出该反应的化学方程式 。
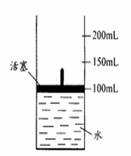
(4)将A、D按一定比例投入下图容器的水中,活塞由100mL处上升到200mL处。现用电火花引燃容器内的气体,在条件不变的情况下,若活塞由200mL处回到150mL处,则原则来投入的A、D物质的物质的量之比为n(A)∶n(D)= 。(假设上述操作能顺利实现,且忽略因投入A、D以及气体溶于水使水面高度变化的影响。)
按照要求填空:
(1)有98%的浓H2SO4(ρ=1.84g/cm3),其物质的量浓度为
(2)等物质的量浓度的NaCl、MgCl2、AlCl3溶液与足量的AgNO3溶液完全反应,若产生相同质量的沉淀,则消耗NaCl、MgCl2、AlCl3溶液的体积之比为
(3)有下列物质:①0.5mol NH3 ②标准状况下22.4L He ③4℃时9mL H2O ④0.2mol H3PO4 请按所含的原子数由多到少的顺序排列(写序号)
(4)在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内.待钠块反应完全后,在容器中收集到1.12L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27g,水槽和容器内溶液的总体积为2.0L,溶液中NaOH的浓度为0.050mol?L-1.试通过计算确定该钠块中氧化钠的质量(写出计算过程).

查看习题详情和答案>>
(1)有98%的浓H2SO4(ρ=1.84g/cm3),其物质的量浓度为
18.4mol?L-1
18.4mol?L-1
,装运该浓硫酸的包装箱应贴的图标为(填序号)A
A
,若要配制500m L 0.2mol?L?1的稀硫酸,需要该浓硫酸的体积为5.4mL
5.4mL
.(2)等物质的量浓度的NaCl、MgCl2、AlCl3溶液与足量的AgNO3溶液完全反应,若产生相同质量的沉淀,则消耗NaCl、MgCl2、AlCl3溶液的体积之比为
6:3:2
6:3:2
.(3)有下列物质:①0.5mol NH3 ②标准状况下22.4L He ③4℃时9mL H2O ④0.2mol H3PO4 请按所含的原子数由多到少的顺序排列(写序号)
①④③②
①④③②
.(4)在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内.待钠块反应完全后,在容器中收集到1.12L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27g,水槽和容器内溶液的总体积为2.0L,溶液中NaOH的浓度为0.050mol?L-1.试通过计算确定该钠块中氧化钠的质量(写出计算过程).


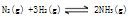 达到平衡后,平衡混合气体平均相对分子质量为12.5,则其中含氨的质量为
达到平衡后,平衡混合气体平均相对分子质量为12.5,则其中含氨的质量为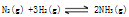 达到平衡后,平衡混合气体平均相对分子质量为12.5,则其中含氨的质量为
达到平衡后,平衡混合气体平均相对分子质量为12.5,则其中含氨的质量为