网址:http://m.1010jiajiao.com/timu3_id_315048[举报]
(09江苏高考化学)(10分)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4能放出大量的热。
(1)已知:2NO2(g)=N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)=N2O4(g) 达到平衡。其它条件不变时,下列措施能提高NO2转化率的是 (填字母)。
A.减小NO2的浓度 B.降低温度C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O (l) ,放出19.14kJ
的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O (l)的△H= kJ·mol-1
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、c(N2O4)=0.0120mol·L-1。计算反应2 NO2(g)![]() N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
(4)现用一定量的Cu 与足量的浓HNO3 反应,制得1.00L已达平衡的N2O4和NO2 混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu 多少克?
查看习题详情和答案>>(10分)按要求回答下列问题:
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是
(2)用电子式表示下列化合物的形成过程
H2S ;MgF2
(3)写出2,2,4—三甲基-3-乙基庚烷的结构简式:
(4)写出(CH3)2CHCH(CH3)(CH2)3CH3的名称:
查看习题详情和答案>>
(10分)第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
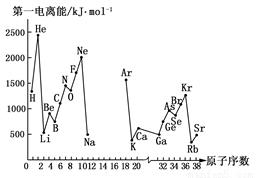
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小(最小)范围为________<Al<________(填元素符号)。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是________。
(3)上图中第一电离能最小的元素在周期表中的位置是________。
(4)根据对角线规则,Be、Al元素最高氧化物的水化物性质相似,它们都具有________,
查看习题详情和答案>>
(10分)实验小组测定某肥料中的总氮含量(以氮的质量分数表示) ,实验装置如下图(图中加热及夹持仪器略去):
称取1.200 g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00 mL浓度为0.5000 mol/L-1硫酸溶液充分吸收,再用浓度为0.1000 mol/L-1氢氧化钠溶液滴定未反应的硫酸。重复上述实验三次。实验数据如下:
| 实验次数 | 氢氧化钠溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | |
| 1 | 0.00 | 5. 01 |
| 2 | 6.00 | 10.99 |
| 3 | 12.00 | 17.60 |
(1)写出圆底烧瓶内发生反应的离子方程式 。
(2)分液漏斗和圆底烧瓶之间的导管a的作用是 ; b的作用是
;冷凝管中从(填“n”或“m”) 口进水。
(3)在滴定过程中,以下操作会使所测总氮含量偏小的是(填序号) 。
A.锥形瓶水洗后未烘干 B.滴定过程中滴定管有漏水现象
C.滴定过程中有少量溶液从锥形瓶中溅出 D.滴定前滴定管内有气泡,滴定后没有了
(4)若实验操作均正确,但测定结果偏低,可能造成该结果的主要原因是 。
(5)利用题目中所给数据计算肥料中总氮含量为 %(计算结果保留到小数点后1位)。
查看习题详情和答案>>