网址:http://m.1010jiajiao.com/timu3_id_314487[举报]
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为____________,其分子属于______________(填“极性”“非极性”)分子。
(2)E是非金属元素,但能表现出一些金属元素的性质,请写出单质E与氢氧化钠溶液反应的离子方程式_____________________________________________________________________。
(3)一定条件下,A的气体单质与B的气体单质充分反应生成6.
(4)A的单质与c的单质在KOH的浓溶液中可以形成原电池,如果以M和N为惰性电极,在电池的M极通入A气体,N极通入C气体,则N极的电极反应式为____________________。
(5)在
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D、C与F分别为同一主族,A、D两元素的原子核内的质子数之和是C、F两元素原子核内质子数之和的一半.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.请回答下列问题:
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为________,其Y分子属于________(填“极性”、“非极性”)分子.
(2)E是非金属元素,但能表现出一些金属元素的性质,请写出单质E与氢氧化钠溶液反应的离子方程式________
(3)一定条件下,A的单质气体与B的单质气体充分反应生成6.8 g W气体[已知n(A)∶n(B)=3∶1],可放出18.44 kJ热量,则该反应的热化学方程式________
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则N极的电极反应式为________.
(5)在10升的密闭容器中,通入2 mol的FC2气体和3 mol C的气体单质,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21 mol/L,则平衡时FC2的转化率为________.
A、B、C、D、E、F六种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C同周期,A与D、C与F分别在同一主族,A、D两元素的原子核内的质子数之和是C、F两元素原子核内质子数之和的一半.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,B、C的常见单质都是空气的主要成分,E是金属元素,但能表现出一些非金属元素的性质.请回答下列问题:
(1)画出D的原子结构示意图________;
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的结构式为________,其分子属于________(填“极性”、“非极性”)分子;
(3)写出单质E与氧氧化钠溶液反应的离子方程式________;
(4)一定条件下,B的最高价氧化物的水化物的浓溶液与红热的木炭反应,则该反应的化学方程式________;
(5)在10 L的密闭容器中,通入2 mol FC2气体和3 mol C2气体,在一定条件下反应生成FC3气体.当反应达到平衡时,C2的浓度为0.21 mol·L-1,则平衡时FC2的转化率为________.
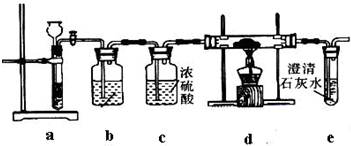
实验I:操作步骤为:
①按图连接装置,检验装置气密性,并往各装置中加入试剂;
②打开装置a上活塞一段时间;
③点燃d处酒精灯,使CO2与Na充分反应.停止加热,继续通气体使双通管冷却.
(1)装置b中装有
(2)步骤②中,当观察到
实验Ⅱ:探究反应产物及反应机理.取反应后双通管中固体物质29.2g进行如下实验:
①将固体溶于足量的水并过滤、洗涤,得到1.8g滤渣(干燥);
②将滤液加水稀释配成250mL的溶液;
③取25.00ml步骤②的溶液,滴加足量BaCl2溶液,将生成的白色沉淀过滤、洗涤、干燥,
称量得固体质量为3.94g.
④另取25.00mL步骤②的溶液,滴加甲基橙作为指示剂,用3.0mol?L-1盐酸滴定,消耗盐酸体积为20.00mL.
(3)步骤②中固体溶于水后过滤,不溶物必须经过洗涤,洗涤的具体操作是
(4)通过实验数据分析29.2g残留固体中,含有哪几种固体?
(5)该探究条件下,钠与二氧化碳反应的化学方程式为
| ||
| ||
某短周期元素原子最外层电子数为次外层的2倍,其单质甲可发生:
甲+乙 丙+丁+水。
丙+丁+水。
(1)若丙为NO2。
①甲与乙反应的化学方程式为 。
② NO2可作火箭重要燃料—肼(N2H4)的助燃剂。N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1,2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=—1135.7 kJ·mol-1,写出肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式: 。
③二甲醚(CH3OCH3)也被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等,“二甲醚燃料电池”是一种绿色电源,其工作原理如图所示。b电极是 极,写出a电极上发生的电极反应式 。
(2)若丙为SO2。
①把乙滴入硫酸铜晶体,观察到的现象是 。
②完成SO2使KMnO4褪色的离子方程式:
MnO4- + SO2 + = Mn2+ + SO42- + H+
③一定条件下:2SO2(g)+O2(g) 2SO3(g) △H<0。反应的平衡常数表达式K= ;反应达平衡时,若改变其中一个条件x,则符合图中曲线的是
2SO3(g) △H<0。反应的平衡常数表达式K= ;反应达平衡时,若改变其中一个条件x,则符合图中曲线的是 
a.x表示温度,y表示n(SO2) b.x表示压强,y表示SO2的转化率
c.x表示n(SO2),y表示n(O2) d.x表示n(SO3),y表示化学平衡常数K