摘要: 大理石与稀盐酸制取二氧化碳:CaCO3+2HCl = CaCl2+H2O+CO2↑
网址:http://m.1010jiajiao.com/timu3_id_31142[举报]
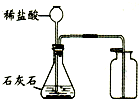 实验室中制取二氧化碳常用
实验室中制取二氧化碳常用稀盐酸
稀盐酸
与大理石
大理石
或石灰石
石灰石
反应来制取.反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
;检验气体是否是二氧化碳的方法是把气体通入澄清的石灰水中,如果石灰水变浑浊,说明是二氧化碳
把气体通入澄清的石灰水中,如果石灰水变浑浊,说明是二氧化碳
;收集方法是向上排空气法
向上排空气法
,如何检验是否收集满二氧化碳把燃烧的木条放在集气瓶口,如果木条熄灭,说明已经收集满
把燃烧的木条放在集气瓶口,如果木条熄灭,说明已经收集满
.1.药品
实验室制取二氧化碳所需要的药品是_______。
2.反应原理
文字表达式可表示为:_____________。
符号表达式为:
CaCO3+HCl![]() CaCl2+H2O+CO2↑
CaCl2+H2O+CO2↑
3.实验装置
制二氧化碳时反应物都是_______体和_______体,反应_______加热,所以用过氧化氢和二氧化锰制氧气的发生装置。需要的仪器可以是:大试管、铁架台、带导管的单孔塞。
也可以用下列仪器:锥形瓶、长颈漏斗、带导管的双孔塞。
因为二氧化碳的密度比空气_______,且_______溶于水,还和水发生化学反应,故只能采用_______收集。
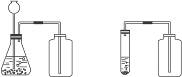
图2-13
4.二氧化碳的检验与验满方法
(1)检验:可用澄清的石灰水检验。方法是将被检验气体通入澄清石灰水中,若澄清的石灰水变_______,证明是二氧化碳,否则不是。
(2)验满:把燃着的木条伸到集气瓶口,若木条_______,证明已收集满;否则,未满。
5.一般采取的操作步骤
(1)连接仪器,检查装置的气密性;(2)装入块状的大理石或石灰石;(3)倒入稀盐酸;(4)用向上排空气法收集二氧化碳。
查看习题详情和答案>>36、(1)实验室制取二氧化碳用块状大理石或石灰石和稀盐酸;
①其反应符号表达式
②可用的发生装置有:

③装置E或F相对于装置C在操作方面的优势为:
④排水法收集与排空气法收集CO2的比较(分别用体积相同的2个集气瓶收集)
⑤写出澄清石灰水变浑浊的化学符号表达
(2)某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,反应速率逐渐减慢甚至停止.为此,该小组设立研究课题:选择合适浓度的硫酸和适当的反应温度制取二氧化碳.
[实验一]选择合适浓度的硫酸
操作:在28℃时,用装有5mL硫酸溶液的注射器向盛有1g直径为2mm大理石的大试管中注入硫酸,记录15分钟内生成气体的体积,见下表
[实验二]选择合适的反应温度
操作:往盛有1g直径为2mm大理石的大试管中分别加入5mL相同合适浓度而不同温度的硫酸溶液,观察反应的情况,记录如下表:
请根据本次活动的研究目的,分析处理以上两个表中数据,得出结论:
①稀硫酸与大理石反应,在28℃时,选用硫酸的浓度最合适为
②在合适的硫酸浓度下,应选择最合适的反应温度为
③除选用适当的温度和合适浓度的硫酸之外,在反应过程中,为防止硫酸钙覆盖在大理石上,应增加
④该研究小组为了研究
查看习题详情和答案>>
①其反应符号表达式
CaCO3+HCl=CaCl2+H2O+CO2↑
.②可用的发生装置有:
BCDEF
(选填上图字母序号).
③装置E或F相对于装置C在操作方面的优势为:
随开随用随关随停
.④排水法收集与排空气法收集CO2的比较(分别用体积相同的2个集气瓶收集)

⑤写出澄清石灰水变浑浊的化学符号表达
CO2+Ca(OH)2=CaCO3↓+H2O
.(2)某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,反应速率逐渐减慢甚至停止.为此,该小组设立研究课题:选择合适浓度的硫酸和适当的反应温度制取二氧化碳.
[实验一]选择合适浓度的硫酸
操作:在28℃时,用装有5mL硫酸溶液的注射器向盛有1g直径为2mm大理石的大试管中注入硫酸,记录15分钟内生成气体的体积,见下表
| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| 硫酸浓度(%) | 15 | 20 | 25 | 30 | 35 |
| 气体体积(mL) | 35 | 47 | 55 | 51 | 42 |
操作:往盛有1g直径为2mm大理石的大试管中分别加入5mL相同合适浓度而不同温度的硫酸溶液,观察反应的情况,记录如下表:
| 试管编号 | A | B | C | D | E |
| 温度(℃) | 40 | 50 | 60 | 70 | 80 |
| 现象和 比较 |
有少量气泡 | 气泡比A号试管多 | 气泡明显比B号试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应激烈,迅速产生大量气体 |
①稀硫酸与大理石反应,在28℃时,选用硫酸的浓度最合适为
25%
,因为浓度小于或大于此浓度对反应的影响是高于或低于此浓度产生气体速度减慢
②在合适的硫酸浓度下,应选择最合适的反应温度为
70
℃,因为温度高于或低于该温度对反应的影响是其它温度反应太慢或太快来不利于收集
③除选用适当的温度和合适浓度的硫酸之外,在反应过程中,为防止硫酸钙覆盖在大理石上,应增加
振荡(摇晃)
操作,更有利于气体的制备.④该研究小组为了研究
固液接触面积(固体形状)
对该反应速率的影响,进行了如下实验.| 试管编号 | A | B |
| 试管内药品 | 1g块状大理石与5mL25%稀硫酸 | 1g粉末状大理石与5mL25%稀硫酸 |
| 现象和比较 | 有少量气泡 | 迅速产生较多气泡 |
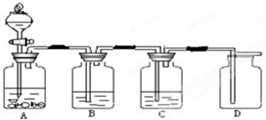 实验室用下图装置制取二氧化碳,并检验它的性质.回答下列问题:
实验室用下图装置制取二氧化碳,并检验它的性质.回答下列问题:(1)若用装置A制取二氧化碳气体,所用药品的名称是
大理石或石灰石
大理石或石灰石
和稀盐酸
稀盐酸
;该反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
.还可以利用装置A制氢气
氢气
气体.(2)若用装置B检验二氧化碳气体,装置B中发生反应的化学方程式为
CO2+Ca(OH)2═CaCO3↓+H2O
CO2+Ca(OH)2═CaCO3↓+H2O
.(3)若用装置C证明二氧化碳与水反应生成碳酸,装置C中可盛放的试液是
石蕊
石蕊
,观察到的现象是溶液变红
溶液变红
.(4)证明装置D中二氧化碳已收集满:
燃着的木条放在集气瓶口
燃着的木条放在集气瓶口
,观察到木条熄灭
木条熄灭
.29、实验室用下图装置制取二氧化碳,并检验它的性质.回答下列问题:

(1)若用装置A制取二氧化碳气体,所用药品的名称是
(2)若用装置B检验二氧化碳气体,装置B中发生反应的化学方程式为
(3)若用装置C证明二氧化碳与水反应生成碳酸,装置C中可盛放的试液是
(4)若用装置B吸收大量的二氧化碳气体,装置B中发生反应的化学方程式为
(5)证明装置D中的二氧化碳已经收集满:将
查看习题详情和答案>>

(1)若用装置A制取二氧化碳气体,所用药品的名称是
稀盐酸与大理石
;该反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑
.(2)若用装置B检验二氧化碳气体,装置B中发生反应的化学方程式为
CO2+Ca(OH)2=CaCO3↓+H2O
.(3)若用装置C证明二氧化碳与水反应生成碳酸,装置C中可盛放的试液是
紫色的石蕊溶液
,观察到的现象是溶液由紫色变为红色
.(4)若用装置B吸收大量的二氧化碳气体,装置B中发生反应的化学方程式为
CO2+2NaOH=Na2CO3+H2O
;(5)证明装置D中的二氧化碳已经收集满:将
燃着的木条放在集气瓶口部
,观察到木条熄灭
.