摘要:38.在一条件下.反应N2 + 3H22NH3在10L恒容密闭容器中进行.测得2min内.N2的物质的量由20mol减少到8mol.则2min内N2的化学反应速率为 A.1.2mol·L﹣1·min﹣1 B.1.0 mol·L﹣1·min﹣1 C.0.6 mol·L﹣1·min﹣1 D.0.4 mol·L﹣1·min﹣1
网址:http://m.1010jiajiao.com/timu3_id_311323[举报]
在一条件下,反应N2+3H2 ![]() 2NH3在10L恒容密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
2NH3在10L恒容密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
A.1.2mol·L-1·min-1 B.1.0 mol·L-1·min-1
C.0.6 mol·L-1·min-1 D.0.4 mol·L-1·min-1
查看习题详情和答案>>在一条件下,反应N??2 + 3H2![]() 2NH3在10L恒容密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
2NH3在10L恒容密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
A.1.2mol·L﹣1·min﹣1 B.1.0 mol·L﹣1·min﹣1
C.0.6 mol·L﹣1·min﹣1 D.0.4 mol·L﹣1·min﹣1
查看习题详情和答案>>在一条件下,反应N2 + 3H2 2NH3在10L恒容密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
2NH3在10L恒容密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
| A.1.2mol·L﹣1·min﹣1 | B.1.0 mol·L﹣1·min﹣1 |
| C.0.6 mol·L﹣1·min﹣1 | D.0.4 mol·L﹣1·min﹣1 |
 A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:
A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:(1)C在元素周期表中的位置为
(2)F单质的燃烧热△H=-akJ/mol,写出表示F单质的燃烧热的热化学方程式
(3)E单质与D的最高价氧化物的水化物的溶液反应的离子方程式为
(4)A、B两元素可形成离子化合物BA5,其电子式为
(5)将0.4mol FC2和0.2mol C2放入容积为2L的_密闭容器中,在一定条件下发生 反应2FC2+C2?2FC3,当FC2百分含量不变时,得到0.2mol FC3气体,则此时反应的平衡常数K=
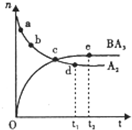
(6)向一绝热恒容密闭容器中通入B2和A2,在一定条件下发生反应B2(g)+3A2(g)?2BA3(g)△H<0,达到平衡,n(A2)和n(BA3)随时间变化的关系如图所示.下列有关叙述一定正确的是
A.c点表示BA3生成速率与BA3分解速率相等
B.c点和e点 A2的转化率相等
C.平衡后再升高温度,不利于BA3的合成
D.d点时:n(A2):n(BA3)=3:2
(7)将E元素的单质(除去氧化膜)投入浓的氯化铜溶液中,在其表面很 快出现一层红色物质,产生气体的速率逐渐加快,经检验,该气体为氢气,用温度计测得溶液的温度迅速升高.请从有关能量、是否有电化学作用等方面,分析能产生氢气且开始 阶段的速率不断加快的原因
二氧化碳碳捕获与封存技术(CCS)可以减少化石燃料燃烧以及其他工业用途的二氧化碳排放量,从而有助于减少温室气体的排放.该技术引起了各国的普遍重视.
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
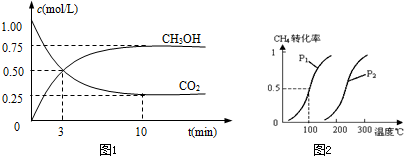
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施中能使n(CH3OH)/n(CO2)增大的是
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3molH2.
Ⅱ.工业上也可以通过下列反应①和②,用CH4和H2O为原料来制备甲醇.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1;②CO(g)+2H2(g)?CH3OH(g)△H2
将0.20mol CH4和0.30molH2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图2.
(1)温度不变,缩小体积,增大压强,①的反应速率
(2)反应①的△H1
,压强为P1,100℃时的平衡常数值是
查看习题详情和答案>>
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图1所示.

①从反应开始到平衡,氢气的平均反应速率v(H2)=
0.225
0.225
mol/(L?min).②下列措施中能使n(CH3OH)/n(CO2)增大的是
CD
CD
.A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3molH2.
Ⅱ.工业上也可以通过下列反应①和②,用CH4和H2O为原料来制备甲醇.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1;②CO(g)+2H2(g)?CH3OH(g)△H2
将0.20mol CH4和0.30molH2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图2.
(1)温度不变,缩小体积,增大压强,①的反应速率
增大
增大
(填“增大”、“减小”或“不变”),平衡向逆反应
逆反应
方向移动.(2)反应①的△H1
>
>
0(填“<”、“=”或“>”),其平衡常数表达式为K=| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
1.35×10-3
1.35×10-3
.