摘要:12.如右图所示.在烧杯中盛有100mL 2mol/L的H2SO4溶液.同时有一表面光滑的塑料小球悬浮于溶液中央.向该烧杯里缓缓注入0.4mol/L的Ba(OH)2溶液至恰好完 全反应.在此过程中: (1)烧杯中观察到的实验现象有:① ② (2)写出实验过程中的离子方程式:
网址:http://m.1010jiajiao.com/timu3_id_310439[举报]
如右图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol?L-150.0mL盐酸,把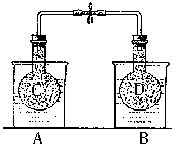 NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把烧瓶C放人A烧杯中,烧瓶D放人B烧杯中。
NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把烧瓶C放人A烧杯中,烧瓶D放人B烧杯中。
往A烧杯中加入50.0gNH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0gNaOH固体搅拌使其溶解。回答下列问题:
(1)烧杯A中温度(填“升高”、“降低”或“不变”)_______;烧杯B中温度(填“升高”、“降低”或“不变”)_______。
(2)已知在NO2生成N2O4的可逆反应里,正反应是放热反应,逆反应是吸热反应:
2NO2(g)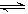 N2O4(g)
N2O4(g)
从上面实验可知烧瓶C内混合气体的颜色(填“变浅”、“变深”或“不变”)______;D烧瓶内混合气体的颜色(填“变浅”、“变深”或“不变”)________。
(3)用pH试纸测定烧杯A中溶液的pH可知其pH(填“大于7”、“等于7”或“小于7”)_________,导致该溶液pH这一变化的原因可用离子方程式表示如下:____________。
(4)若实验测得B烧杯中酸碱中和反应放热1.4325kJ,则NaOH溶液和HCl溶液发生中和反应的热化学方程式为________________________________。
(5)若起始时在D烧瓶中充人mgN2O4,此时测得烧瓶中的压强为1.01×105Pa,当可逆反应:N2O4(g)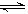 2NO2(g)达到化学平衡状态时压强变为1.515×105Pa,则平衡混合气体的平均相对分子质量为___________(精确到小数点后两位)。
查看习题详情和答案>>
2NO2(g)达到化学平衡状态时压强变为1.515×105Pa,则平衡混合气体的平均相对分子质量为___________(精确到小数点后两位)。
查看习题详情和答案>>
 NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把烧瓶C放人A烧杯中,烧瓶D放人B烧杯中。
NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把烧瓶C放人A烧杯中,烧瓶D放人B烧杯中。往A烧杯中加入50.0gNH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0gNaOH固体搅拌使其溶解。回答下列问题:
(1)烧杯A中温度(填“升高”、“降低”或“不变”)_______;烧杯B中温度(填“升高”、“降低”或“不变”)_______。
(2)已知在NO2生成N2O4的可逆反应里,正反应是放热反应,逆反应是吸热反应:
2NO2(g)
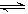 N2O4(g)
N2O4(g)从上面实验可知烧瓶C内混合气体的颜色(填“变浅”、“变深”或“不变”)______;D烧瓶内混合气体的颜色(填“变浅”、“变深”或“不变”)________。
(3)用pH试纸测定烧杯A中溶液的pH可知其pH(填“大于7”、“等于7”或“小于7”)_________,导致该溶液pH这一变化的原因可用离子方程式表示如下:____________。
(4)若实验测得B烧杯中酸碱中和反应放热1.4325kJ,则NaOH溶液和HCl溶液发生中和反应的热化学方程式为________________________________。
(5)若起始时在D烧瓶中充人mgN2O4,此时测得烧瓶中的压强为1.01×105Pa,当可逆反应:N2O4(g)
 2NO2(g)达到化学平衡状态时压强变为1.515×105Pa,则平衡混合气体的平均相对分子质量为___________(精确到小数点后两位)。
查看习题详情和答案>>
2NO2(g)达到化学平衡状态时压强变为1.515×105Pa,则平衡混合气体的平均相对分子质量为___________(精确到小数点后两位)。
查看习题详情和答案>>
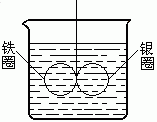 (3分)如右图所示,在盛有水的烧杯中,等质量的铁圈和银圈的连接处,吊着一根绝缘的细丝,使之平衡。小心地在烧杯中央滴入CuSO4溶液。
(3分)如右图所示,在盛有水的烧杯中,等质量的铁圈和银圈的连接处,吊着一根绝缘的细丝,使之平衡。小心地在烧杯中央滴入CuSO4溶液。
⑴经过一段时间后,观察到的现象是(指金属圈) 。
A.铁圈和银圈左右摇摆不定
B.保持平衡状态不变
C.铁圈向下倾斜
D.银圈向下倾斜
⑵产生上述现象的原因是 。
查看习题详情和答案>>如右图所示,在U形管中加入Na2SO4溶液,再加入几滴石蕊试液,插入惰性电极,接通电源。
(1)一段时间后可观察到的现象是__________。
(2)切断电源,取出电极,将在U形管中的溶液倒入一小烧杯中,搅拌,可观察到的现象是___________,其原因是_____________。
(3)若改用该装置电解滴有几滴酚酞试液的饱和Na2CO3溶液,一段时间后可观察到阳极___________,阴极_________。

在中学化学实验中,通常用无水硫酸铜来检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
方法甲:取2药匙细小的硫酸铜晶体置于 中研碎后放入坩埚,将坩埚放在 上用小火慢慢加热并用玻璃棒不停搅拌,最后将坩埚移入 中进行冷却(请选用合适仪器填空:表面皿、研钵、烧杯、通风橱、试管夹、干燥器、泥三角).
方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干.
[交流与讨论]
(1)方法甲中,加热温度稍高时会出现变黑现象,原因是 (用化学方程式表示).
(2)方法乙中,浓硫酸的作用是 ;为了不浪费药品,对无水乙醇洗涤液进行再生的方法是 ,所用的主要玻璃仪器有烧瓶、接液管、锥形瓶 等.
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想 .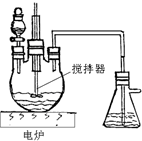
(4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4?5H2O的新工艺.模拟制备装置如右图所示.
[问题一]如图装置中,分液漏斗内装的液体是 ,反应结束时,获取CuSO4?5H2O的操作过程是先 ,趁热将三颈瓶中的液体倒入烧杯中冷却,析出晶体CuSO4?5H2O,过滤、晾干.
[问题二]工业上用石灰乳吸收尾气,除了防止环境污染外,还能得到了有经济实用价值的副产品--亚硝酸钙.尾气吸收生成亚硝酸钙的化学方程式是 .
查看习题详情和答案>>
方法甲:取2药匙细小的硫酸铜晶体置于
方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干.
[交流与讨论]
(1)方法甲中,加热温度稍高时会出现变黑现象,原因是
(2)方法乙中,浓硫酸的作用是
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想

(4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4?5H2O的新工艺.模拟制备装置如右图所示.
[问题一]如图装置中,分液漏斗内装的液体是
[问题二]工业上用石灰乳吸收尾气,除了防止环境污染外,还能得到了有经济实用价值的副产品--亚硝酸钙.尾气吸收生成亚硝酸钙的化学方程式是
 实验室配制500mL 0.500mol?L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.500mol?L-1的NaCl溶液,有如下操作步骤:①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液小心转入500mL容量瓶中;
③继续向容量瓶中加蒸馏水至液面距刻度1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹面底部与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞塞紧,充分摇匀.
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)
①②④③⑤
①②④③⑤
.(2)本实验必须用到的玻璃仪器有
烧杯
烧杯
,玻璃棒
玻璃棒
,500mL容量瓶
500mL容量瓶
,胶头滴管
胶头滴管
.(3)某同学观察液面的情况如右图所示,对所配溶液浓度将有何影响?
偏高
偏高
(选填“偏高”、“偏低”或“无影响”).(4)若没有进行操作步骤④,对所配溶液浓度将有何影响?
偏低
偏低
.(选填“偏高”、“偏低”或“无影响”).(5)若实验过程中出现如下情况,应如何处理?
①加蒸馏水时不慎超过了刻度线:
重新配置
重新配置
.②向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面:
重新配置
重新配置
.