摘要:12.AlCl3溶液中加入过量的NaOH溶液:Al3+ + 3OH- == Al(OH)3↓
网址:http://m.1010jiajiao.com/timu3_id_310413[举报]
含AlCl3 13.35g的溶液中加入一定浓度的NaOH溶液100mL后,结果得到沉淀3.9g.
(1)写出可能发生反应的离子方程式:
(2)上述NaOH溶液物质的量浓度可能是多少?(写出计算过程)
查看习题详情和答案>>
(1)写出可能发生反应的离子方程式:
Al3++3OH-=Al(OH)3↓
Al3++3OH-=Al(OH)3↓
、Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
;(2)上述NaOH溶液物质的量浓度可能是多少?(写出计算过程)
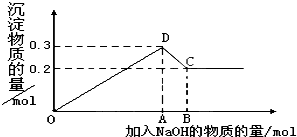 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如图所示.则:
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如图所示.则:(1)写出代表各线段发生反应的离子方程式:
OD段
Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓
Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓
,DC段
Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+OH-═AlO2-+2H2O
.(2)原溶液中Mg2+、Al3+物质的量浓度之比为
2:1
2:1
.(3)图中C点表示当加入
0.8
0.8
mol NaOH时,Al3+已经转化为AlO2-
AlO2-
Mg2+已经转化为Mg(OH)2
Mg(OH)2
.(4)图中线段OA:AB=
7:1
7:1
. 向20mL某物质的量浓度的AlCl3溶液中滴加2mol/L NaOH溶液时,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如图所示.则:
向20mL某物质的量浓度的AlCl3溶液中滴加2mol/L NaOH溶液时,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如图所示.则:(1)写出OA段发生反应的离子方程式:OA段
Al3++3OH-=Al(OH)3↓
Al3++3OH-=Al(OH)3↓
,图中线段OP:PB=3:1
3:1
.(2)计算原AlCl3溶液的物质的量浓度为
0.5
0.5
mol/L(3)图中A对应的横坐标为
15
15
mL(4)当加入5ml NaOH溶液时,产生沉淀量为
0.0033
0.0033
mol.(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,加入NaOH溶液的体积为
18.33
18.33
.