网址:http://m.1010jiajiao.com/timu3_id_308785[举报]
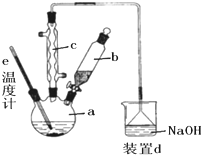
 实验室制取溴苯的装置示意图及有关数据如下:
实验室制取溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g?cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入液溴,至
液溴滴完.
①装置d中NaOH的作用是
②a的名称是
③该反应是否要加热
A.直接加热 B.水浴加热 C.不需加热
(2)反应完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为
A.分液 B. 过滤 C.萃取 D.蒸馏
(4)在该实验中,a的容积最适合的是
A.25mL B.50mL C.250mL D.500mL.
| 苯 | 溴 | 溴苯 | |
| 密度/g?cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入液溴,至
液溴滴完.
①装置d中NaOH的作用是______;
②a的名称是______;
③该反应是否要加热______(填下列字母)
A.直接加热B.水浴加热C.不需加热
(2)反应完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是______
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是______
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须的是______(填入正确选项前的字母);
A.分液B.过滤C.萃取D.蒸馏
(4)在该实验中,a的容积最适合的是______(填入正确选项前的字母).
A.25mLB.50mLC.250mLD.500mL.
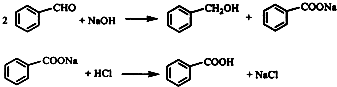
已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃).
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸.
③石蜡油沸点高于250℃
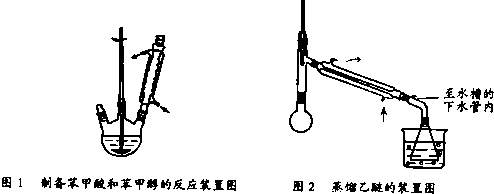
实验步骤如下:
①向图l 所示装置中加入8g氢氧化钠和30mL水,搅拌溶解.稍冷,加入10mL苯甲醛.开启搅拌器,调整转速,使搅拌平稳进行.加热回流约40min.
②停止加热,从球形冷凝管上口缓缓加入冷水20mL,摇动均匀,冷却至室温.反应物冷却至室温后,用乙醚萃取三次,每次
10mL.水层保留待用.合并三次萃取液,依次用5mL饱和亚硫酸氢钠溶液洗涤,10mL 10%碳酸钠溶液洗涤,10mL水洗涤,分液水层弃去所得醚层进行实验③.
③将分出的醚层,倒入干燥的锥形瓶,加无水硫酸镁,注意锥形瓶上要加塞.将锥形瓶中溶液转入图2 所示蒸馏装置,先缓缓加热,蒸出乙醚;蒸出乙醚后必需改变加热方式,升温至140℃时应对水冷凝管冷凝方法调整,继续升高温度并收集203℃~205℃的馏分得产品A.
④实验步骤②中保留待用水层慢慢地加入到盛有30mL浓盐酸和30mL水的混合物中,同时用玻璃棒搅拌,析出白色固体.冷却,抽滤,得到粗产品,然后提纯得产品B.
根据以上步骤回答下列问题:
(1)步骤②萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需
(2)饱和亚硫酸氢钠溶液洗涤是为了除去


(3)步骤③中无水硫酸镁是
(4)蒸馏除乙醚的过程中采用的加热方式为
(5)提纯产品B 所用到的实验操作为
实验室中盐酸的用途十分广泛,常常用来制备气体。
(1)某小组同学欲用4 mol/L的盐酸配制230 mL 0.4mol/L 盐酸溶液,需取用4 mol/L盐酸 mL,实验中需要用到的玻璃仪器有 、 、量筒、 烧杯、胶头滴管。
(2)下列实验操作使配制的溶液浓度偏低的是
A.容量瓶洗涤后未干燥
B.移液时,有少量溶液溅出
C.定容时,加水不慎超过刻度线,又倒出一些
D.定容时,俯视刻度线
E.装入试剂瓶时,有少量溶液溅出
(Ⅱ)(16分)瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气。已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。( 3Cl2+6KOH ![]() KClO3+5KCl+3H2O )
KClO3+5KCl+3H2O )
 |
图中:A为氯气发生装置;B的试管里盛有15 mL 30% KOH溶液,并置于水浴中;C的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;D的试管里加有紫色石蕊试液。
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过 (填仪器名称)向圆底烧瓶中加入适量的浓盐酸。装置A中反应的离子方程式 。
(2) 反应完毕经冷却后,B的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 (填编号字母);从B的试管中分离出该晶体的方法是 (填实验操作名称)。该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有杂质,该杂质成分 (除水蒸气外,填化学式),如何改进 ;
反应完毕经冷却后,B的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 (填编号字母);从B的试管中分离出该晶体的方法是 (填实验操作名称)。该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有杂质,该杂质成分 (除水蒸气外,填化学式),如何改进 ;
(3)实验中可观察到D的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
|
(4)请在装置图方框中画出缺少的实验装置,并注明试剂。
查看习题详情和答案>>