网址:http://m.1010jiajiao.com/timu3_id_308346[举报]
(11分)已知某工业废水中含有CuCl2、FeCl2、HCl,某化学探究学习小组打算用这种废水制备纯净的FeCl2晶体。为此他们设计了如下的实验方案: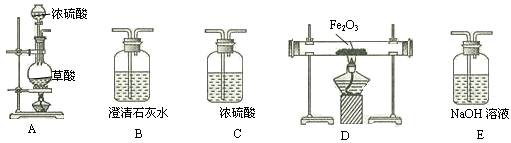
第一步:用上图中的仪器和药品组装一套实验装置制取干燥的CO,用CO还原Fe2O3粉末制取还原铁粉。提示:制取CO的原理为 。
。
(1)如果所制气体流向从左向右时,上述组装的实验装置从左向右的实验装置连接顺序(填仪器序号)是 
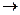
 。
。
(2)正确的操作第一步应是 ;最后一步应是熄灭 处的酒精灯。
(3)装置B的作用是 ;装置E的作用是 。
(4)第二步:将制得的还原铁粉放入原混合溶液中,制得纯净的FeCl2溶液。
必须进行的操作是 。
(5)第三步:得到纯净的FeCl2晶体。
必须进行的操作是 。
已知某工业废水中含有CuCl2、FeCl2、HCl,某化学探究学习小组打算用这种废水制备纯净的FeCl2晶体。为此他们设计了如下的实验方案:

第一步:用上图中的仪器和药品组装一套实验装置制取干燥的CO,用CO还原Fe2O3粉末制取还原铁粉。提示:制取CO的原理为![]() 。
。
(1)如果所制气体流向从左向右时,上述组装的实验装置从左向右的实验装置连接顺序(填仪器序号)是 ![]()
![]()
![]()
![]() 。
。
(2)正确的操作第一步应是 ;最后一步应是熄灭 处的酒精灯。
(3)装置B的作用是 ;装置E的作用是 。
(4)第二步:将制得的还原铁粉放入原混合溶液中,制得纯净的FeCl2溶液。
必须进行的操作是 。
(5)第三步:得到纯净的FeCl2晶体。
必须进行的操作是 。
查看习题详情和答案>>
第一步:用上图中的仪器和药品组装一套实验装置制取干燥的CO,用CO还原Fe2O3粉末制取还原铁粉。提示:制取CO的原理为
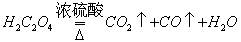 。
。(1)如果所制气体流向从左向右时,上述组装的实验装置从左向右的实验装置连接顺序(填仪器序号)是
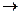
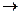
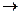
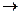 。
。(2)正确的操作第一步应是 ;最后一步应是熄灭 处的酒精灯。
(3)装置B的作用是 ;装置E的作用是 。
(4)第二步:将制得的还原铁粉放入原混合溶液中,制得纯净的FeCl2溶液。
必须进行的操作是 。
(5)第三步:得到纯净的FeCl2晶体。
必须进行的操作是 。
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2.
II.对I中所得到的溶液按下列步骤进行提纯.

已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(1)下列物质中,最适合作为氧化剂X的是
A.KMnO4 B.K2Cr2O4 C.H2O2 D.NaClO
(2)①加入的物质Y是
 Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq) Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq)(3)分离出沉淀Z,并将滤液蒸发,欲获得氯化铜晶体(CuCl2?2H2O),应采取的措施是
(4)①某同学利用反应:Cu+2H+═Cu2++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为
(5)已知一些难溶物的浓度积常数如下表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
①NaOH ②FeS ③Na2S.