网址:http://m.1010jiajiao.com/timu3_id_30726[举报]
小意和小思同学对化学计算很有心得。以下是他们解答一道计算题的实录。
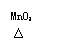 请你一起参与研究并完成相关问题。(计算结果精确到0.01)
请你一起参与研究并完成相关问题。(计算结果精确到0.01)
[题目] 已知: 2KClO3 === 2KCl + 3O2↑,将10g氯酸钾和2g二氧化锰混合后放入试管中加热,收集所需量的氧气后,停止加热让试管冷却,称得试管内剩余固体的质量为7.2g。求生成氯酸钾的质量。
(1)小意很快得到(10g + 2g 7.2g)是 (填化学式)的质量,进而求出KCl 的质量是 g.
请你简单写出小意计算KCl 的质量的过程。
(2)小思依据上述计算的结果发现题目数据有问题。请你通过简单的计算,论证他的发现。
(3)如何才能更正该题呢?小意和小思认为有许多方法,例如将题目中“10g氯酸钾”改为“ag氯酸钾”,其它物质的质量不变,则a的取值范围是 。
查看习题详情和答案>>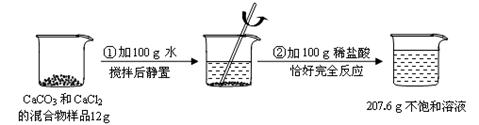 请根据下图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:
请根据下图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:
(1)生成二氧化碳质量= g;
(2)计算原混合物样品中CaCO 3的质量;
3的质量;
(3)计算实验所用稀盐酸的溶质的质量分数。(写出计算过程,结果精确到0.1%)
查看习题详情和答案>>铁矿石冶炼成铁是一个复杂的过程。炼铁的原理是利用一氧化碳与氧化铁的反应,该化学方程式为 ▲ 。
(1)某钢铁厂每天需消耗5000t含氧化铁76%的赤铁矿石,该厂理论上可以日产含铁98%的生铁的质量是多少?
(请写出计算过程,结果精确到0.1t)▲
(2)某化学兴趣小组在实验室中模拟炼铁原理的实验,并对固体产物的成分进行探究。
 【设计实验】 用一氧化碳还原纯净的氧化铁粉末,实验装置如右图,酒精灯b的作用是 ▲ 。
【设计实验】 用一氧化碳还原纯净的氧化铁粉末,实验装置如右图,酒精灯b的作用是 ▲ 。
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)。
②反应后玻璃管和内盛黑色固体的总质量m(冷却到室温称量)。
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关。
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁。
③
| 物质 性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
【进一步实验和得出结论】
①该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和 ▲ 。
②该小组同学将黑色固体粉末投入硫酸铜溶液中,一段时间后无紫红色固体析出,则该黑色固体粉末为 ▲ 。其实,进行如上图所示实验后,若测得反应后玻璃管和内盛黑色固体的总质量m为 ▲ g,也能得出这个结论。
【反思与评价】一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度和延长反应时间。上图所示实验装置中,应作的一处修改是 ▲ 。
查看习题详情和答案>>某集团是一家以生产电缆类产品为主的国家大型企业。在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法。
甲同学根据已学知识,提出了一套回收方案:
 |
![]() 乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu + 2H2SO4 + O2 2CuSO4 + 2H2O),于是他提出了另一套方案:
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu + 2H2SO4 + O2 2CuSO4 + 2H2O),于是他提出了另一套方案:
 |
(1)甲方案的①②③三个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
① ;② ;
③ 。
(2)从环保角度对两套方案的不同部分进行比较,你认为 (填“甲”或“乙”)的方案更合理。理由是: 。
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑。你认为丙这么说的道理是: 。(2分)
丁又提出了疑问:“如果铁过量,剩余的铁会混在红色粉末中,该怎么处理呢?”。请提出你的想法: 。
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益。请写出使“绿矾”结晶的两种可能方法: 、 (“绿矾”溶解度随温度升高而增大)。如果直接排放掉滤液,不仅造成了浪费,还会 。
(5)若上述方案所用的稀硫酸溶质质量分数为36.8%,问每1000mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸 g,需水 mL(水的密度为1.0g/mL)。在实验室中稀释浓硫酸时,是如何操作的: 。(2分)
![]() (6)根据乙同学查出的方程式(2Cu + 2H2SO4 + O2 2CuSO4 + 2H2O)计算:如果1000mL98%的浓硫酸(密度为1.84g/mL)稀释后全部参加了反应(假设硫酸不和碎电缆皮、其他杂质反应),所能处理的废料中含纯铜多少克?(请写出计算过程,结果精确到0.1克。5分)
(6)根据乙同学查出的方程式(2Cu + 2H2SO4 + O2 2CuSO4 + 2H2O)计算:如果1000mL98%的浓硫酸(密度为1.84g/mL)稀释后全部参加了反应(假设硫酸不和碎电缆皮、其他杂质反应),所能处理的废料中含纯铜多少克?(请写出计算过程,结果精确到0.1克。5分)