摘要:氧化铜与硫酸反应 CuO + H2SO4 === CuSO4 + H2O 现象:黑色粉末溶解.溶液变成蓝色
网址:http://m.1010jiajiao.com/timu3_id_3069[举报]
胆矾(CuSO4?5H2O)是重要的化工原料,工业上用Cu与浓H2SO4、浓HNO3反应制备该物质,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4?5H2O的新工艺.模拟制备装置如图所示,根据题意回答下列问题.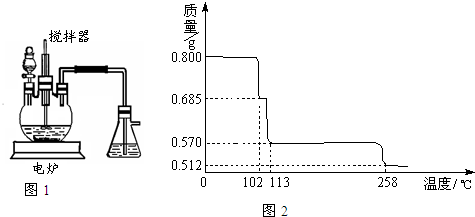
(1)如图1装置中,分液漏斗内装的液体是
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4?5H2O中常常含有的杂质是一种硝酸盐,其化学式是
(3)用无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此现象你的猜想是
(4)将0.80g CuSO4?5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图2所示.
①由图2中可以看出,CuSO4?5H2O分解的最低温度是
②试通过计算确定238℃时固体物质的化学式.(要计算过程)
③将CuSO4?5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的最高价氧化物和水蒸气,该反应的化学方程式为
查看习题详情和答案>>

(1)如图1装置中,分液漏斗内装的液体是
浓硝酸
浓硝酸
(填“浓硝酸”或“浓硫酸”),该发应会产生有毒气体NO、NO2等,锥形瓶中液体可以吸收该气体,反应原理为:NO+NO2+2NaOH=2NaNO2(该物质化学名是亚硝酸钠
亚硝酸钠
)+H2O.该装置中搅拌器的作用是充分接触,加快反应速率
充分接触,加快反应速率
.反应所得产品在三颈烧瓶
三颈烧瓶
(填“三颈烧瓶”或“锥形瓶”)中.(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4?5H2O中常常含有的杂质是一种硝酸盐,其化学式是
Cu(NO3)2
Cu(NO3)2
,已知10℃、20℃时有关物质的溶解度为:CuSO4?5H2O(17.4g、20.7g);该硝酸盐(95.3g、125.1g),提纯CuSO4?5H2O的实验操作是重结晶(或冷却结晶)
重结晶(或冷却结晶)
.(3)用无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此现象你的猜想是
铜离子作催化剂,双氧水分解出氧气
铜离子作催化剂,双氧水分解出氧气
,检验该气体的实验操作是用带火星木条检验,看是否复燃
用带火星木条检验,看是否复燃
.(4)将0.80g CuSO4?5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图2所示.
①由图2中可以看出,CuSO4?5H2O分解的最低温度是
102℃
102℃
.②试通过计算确定238℃时固体物质的化学式.(要计算过程)
③将CuSO4?5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的最高价氧化物和水蒸气,该反应的化学方程式为
CuSO4?5H2O
CuO+SO3↑+5H2O↑
| ||
CuSO4?5H2O
CuO+SO3↑+5H2O↑
.
| ||
 硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:
硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:Ⅰ、硫酸铜的制备
(1)某学习小组同学利用铜屑、稀硫酸为原料制备硫酸铜.其原理是在高温条件下将铜粉反复灼烧,使铜充分氧化成氧化铜,再将氧化铜与稀硫酸反应制备硫酸铜,请写出相应的化学方程式
2Cu+O2
2CuO
| ||
2Cu+O2
2CuO
、
| ||
CuO+H2SO4=CuSO4+H2O
CuO+H2SO4=CuSO4+H2O
;(2)通过查阅资料,同学们找到了一种工业制备硫酸铜晶体(CuSO4?xH2O)的流程,具体如下:将铜丝放到稀硫酸中,控温在50℃.加入10%的H2O2,反应0.5h后,升温到60℃,持续反应1h后,过滤、蒸发、降温结晶等,用少量95%的酒精淋洗后晾干,得CuSO4?5H2O.
①写出该工艺流程生成CuSO4的化学方程式
Cu+H2O2+H2SO4=CuSO4+2H2O
Cu+H2O2+H2SO4=CuSO4+2H2O
;②在上述生产过程中,控制温度在50℃和60℃加热的原因为
防止H2O2受热分解
防止H2O2受热分解
,③上述生产流程的优点有
耗能少
耗能少
(写出一种即可);④在过滤时,采用了右图所示的装置,你认为这样做的优点是
加快过滤的速度
加快过滤的速度
;Ⅱ、硫酸铜的应用及相关实验
(1)波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,其有效成分是Cu4(OH)6SO4,其中铜元素的化合价为
+2价
+2价
,该化学式可以写成盐和碱的形式CuSO4?3Cu(OH)2
CuSO4?3Cu(OH)2
,其杀菌机理可看作是Cu2+使病原菌失去活性,这说明病原菌的主体是蛋白质
蛋白质
(填一种有机物名称).(2)为验证Al的化学性质比铜活泼,小怡做了以下实验,现象如下表:
| Al片(未打磨) | Al片(打磨) | |
| CuSO4溶液 (5%,5mL) |
无变化,数小时后铝片上附有极少气泡,几乎无红色物质 | 极少气泡,附着极少红色物质,持续较长时间 |
| CuSO4溶液 (10%,5mL) |
无变化,数小时后铝片附有稍多气泡,仅有极少红色斑点 | 稍多气泡,附着极少(多于5%)红色物质,持续较长时间 |
| CuCl2溶液 (5%,5mL) |
多量气泡,迅速出现红色物质,很快溶液变成无色,且温度升高 | 更多量气泡,迅速出现红色物质,很快溶液变成无色,且温度升高 |
①铝和铜盐溶液反应速率与
铝片是否打磨
铝片是否打磨
、硫酸铜溶液的浓度
硫酸铜溶液的浓度
和不同的铜盐
不同的铜盐
有关,同时说明铜盐溶液中的Cl-能加快
加快
(填“加快”或“抑制”)反应速率,若实验室没有CuCl2溶液,则可以在CuSO4溶液中加入少许盐酸
盐酸
(填物质名称),以使实验现象更为明显;②该反应过程要
放热
放热
(填“吸热”或“放热”).经检验,产生的气体是一种能燃烧的单质,该气体是H2
H2
(填化学式);Ⅲ、硫酸铜晶体(CuSO4?xH2O)中结晶水(xH2O)含量的测定
在老师的指导下,学习小组取12.5g硫酸铜晶体(CuSO4?xH2O)进行热分解,获得相关数据,并绘制成固体质量-温度的关系如下图.
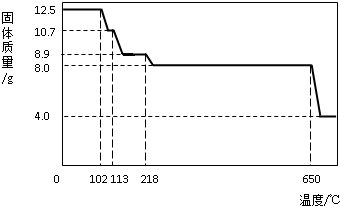
(1)在加热过程中,随着水分的蒸发,固体颜色将由蓝色逐渐变为
白
白
色,最终变为黑色;(2)写出固体质量由10.7g变为8.9g时的化学方程式
CuSO4?xH2O
CuSO4+xH2O↑
| ||
CuSO4?xH2O
CuSO4+xH2O↑
;
| ||
(3)650℃以上时,硫酸铜固体就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为
2CuSO4
2CuO+2SO2↑+O2↑
| ||
2CuSO4
2CuO+2SO2↑+O2↑
;
| ||
(4)根据图中数据,计算CuSO4?xH2O中的CuSO4的质量分数.(要求:根据x的值进行计算,CuSO4的相对分子质量:160,H2O的相对分子质量:18)
18、请你参与下列探究:
【问题情景】某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出.这一现象激发起同学们的探究欲望,生成的是什么气体?
【提出猜想】从物质组成元素的角度,放出的气体可能是SO2、O2、H2.
【查阅资料】SO2易溶于水,它能与NaOH反应,生成Na2SO3.
【方案设计】依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量.写出SO2与NaOH反应的化学方程式
(3)实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体.
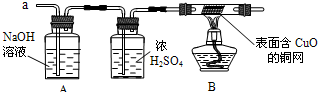
如果放出的是O2和H2,你认为方案中的安全隐患是
丙同学认为:为确保安全,实验前应先收集一试管气体,用拇指
【实验探究】经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减.
结论:铁粉与硫酸铜溶液反应时,产生的气体是
【思维拓展】
(1)由上述实验可以推出,硫酸铜溶液中可能含有
(2)不通过称量,如何判断SO2与NaOH溶液发生了反应呢?有一同学设计了右图所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论.其他同学认为这一方案不严谨,理由是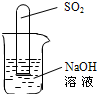
CuSO4溶液对过氧化氢的分解具有催化作用.有同学想猜想其他盐溶液也能在这个反应中起到同样的作用,于是他们做了以下的探究:
(1)清你帮助他们完成实验报告:
(2)已知FeCl3在水中可分离出Fe3+和Cl-,同学们提出以下猜想:
①甲同学的猜想:真正催化分解H2O2的是FeCl3溶液中的H2O;
②乙同学的猜想:真正催化分解H2O2的是FeCl3溶液中的Fe3+;
③丙同学的猜想:真正催华分解 H2O2的是FeCl3溶液中的Cl-;
你认为最不可能的是
(3)同学们对余下的两个猜想,用实验进行了探究.请你仔细分析后填表:
用18mol/L的硫酸配置100ml 1.0mol/L的稀硫酸,若实验仪器有:
A.100ml量筒 B.托盘天平 C.玻璃棒 D.50ml容量瓶
E.10ml量筒 F.胶头滴管 G.50ml烧杯 H.100ml容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号)
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配置溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm-2cm处,用滴管滴加蒸馏水到标线.
D.配置溶液时,如果试样是液体,用量筒量取后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm-2cm处,用滴管加入蒸馏水到标线.
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次.
查看习题详情和答案>>
【问题情景】某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出.这一现象激发起同学们的探究欲望,生成的是什么气体?
【提出猜想】从物质组成元素的角度,放出的气体可能是SO2、O2、H2.
【查阅资料】SO2易溶于水,它能与NaOH反应,生成Na2SO3.
【方案设计】依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是
用带火星的木条试验,看木条是否复燃
.(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量.写出SO2与NaOH反应的化学方程式
SO2+2NaOH=Na2SO3+H2O
.(3)实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体.

如果放出的是O2和H2,你认为方案中的安全隐患是
实验时剩余气体B通过加热的试管易发生爆炸事故
.丙同学认为:为确保安全,实验前应先收集一试管气体,用拇指
堵住试管囗,靠近火焰点火,
,若不发出尖锐的爆鸣声
,方可采用上面的装置进行实验.【实验探究】经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减.
结论:铁粉与硫酸铜溶液反应时,产生的气体是
H2
.【思维拓展】
(1)由上述实验可以推出,硫酸铜溶液中可能含有
H2SO4
物质.(2)不通过称量,如何判断SO2与NaOH溶液发生了反应呢?有一同学设计了右图所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论.其他同学认为这一方案不严谨,理由是

SO2溶于水中也会导致试管内气压减小,液面上升
.要得到科学严谨的结论,仍利用该装置,补做的实验是把烧杯中的氢氧化钠换成硫酸钠溶液,做一个对比试验
.CuSO4溶液对过氧化氢的分解具有催化作用.有同学想猜想其他盐溶液也能在这个反应中起到同样的作用,于是他们做了以下的探究:
(1)清你帮助他们完成实验报告:
| 实验过程 | 实验现象 | 实验结论 |
| 在一支试管中加入5ml5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管. | 试管中有大量的气泡产生,伸入的带火星的木条复燃 |
FeCl3溶液可以催化分解H2O2 |
①甲同学的猜想:真正催化分解H2O2的是FeCl3溶液中的H2O;
②乙同学的猜想:真正催化分解H2O2的是FeCl3溶液中的Fe3+;
③丙同学的猜想:真正催华分解 H2O2的是FeCl3溶液中的Cl-;
你认为最不可能的是
甲
同学的猜想,理由是因过氧化氢溶液中自身有水,可见水不是催化剂
.(3)同学们对余下的两个猜想,用实验进行了探究.请你仔细分析后填表:
| 实验过程 | 实验现象 | 实验结论 |
| 向盛有5ml5%的H2O2溶液的试管中加入少量的HCl,并把带火星的木条伸入试管 | 无明显现象 | 起催化作用的不是Cl- |
| 向盛有5ml5%的H2O2溶液的试管中加入少量的 Fe(NO3)3溶液 ,并把带火星的木条伸入试管 |
试管中有大量气泡产生,带火星的木条复燃 |
起催化作用的是Fe3+ |
A.100ml量筒 B.托盘天平 C.玻璃棒 D.50ml容量瓶
E.10ml量筒 F.胶头滴管 G.50ml烧杯 H.100ml容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号)
F、E、G、C、H
.(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)
B、C、D
.A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配置溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm-2cm处,用滴管滴加蒸馏水到标线.
D.配置溶液时,如果试样是液体,用量筒量取后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm-2cm处,用滴管加入蒸馏水到标线.
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次.
23、人类发展的历史进程中人们不断研制出各种不同的用具,制造用具的材料也在不断地发生变化,金属制品因其美观、耐用、轻便易成型而被人们广泛利用,请根据所学知识及生活知识参与有关金属制品探究.
(1)以下工具的制作过程中没有发生化学变化的是(
A.原始人制作石刀;B.冶炼青铜;C.炼铁
(2)请将以下金属材料的冶炼按年代的先后顺序排序
A.铁;B.青铜;C.铝
从以上顺序可以看出,金属制品的出现顺序与
(3)金属区别于非金属的主要物理性质是,金属具有
(4)孔雀石主要成分为碱式碳酸铜,经加热会发生反应:Cu2(OH)2CO3△2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:
(5)古代术士将炉甘石(主要成分为ZnCO3)与赤铜矿(Cu2O)、木炭放在炼炉中高温灼烧,炼出金光灿灿的“黄金”,被称为“炼石成金”.
①请你用学过的知识回答,真的可以“炼石成金”吗?
②那么你认为这金光灿灿的金属是什么?它是怎么炼出来的?写出有关化学方程式
该金属可能是
(6)到西汉时期我国的劳动人民又发明了“湿法炼铜”,在西汉刘安所著的《淮南万毕术》中就有“曾青得铁则化为铜”的记载(“曾青”是指铜的化合物),请用反应方程式表示其冶炼原理:
(7)磁悬浮的核心技术得制备超导材料.有一种超导材料的化学式为Y2BaCu6O10,它是以YmOn、BaCO3和CuO为原料经研磨烧结而成.假设此过程中所有元素的化合价不变,试填写以下空白:
a.超导材料Y2BaCu6O10是由
b.在合成该超导材料的同时还生成-种产物,该物质是
金属的使用及冶炼历史也引起同学们极大兴趣,初三同学组织化学兴趣小组继续进行(8)(9)探究:
(8)首先他们收集大量有关钢铁的成语与民间谚语.其中有说明钢的性能比铁好的有
(9)钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究.
[提出假设]a. Ti的金属活动性比Mg强;
b.Ti的金属活动性介于Mg和Ag之间.
[查阅资料]在相同条件下,金属与酸反应,产生气泡的速率越快,则该金属活动性越强.
[实验设计]同温下,取大小相同的这三种金属薄片,分别投入等体积、等浓度的足量稀盐酸中,观察现象.
请回答:三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是
[实验现象]
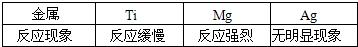
[实验结论]原假设中
[结论]用不同浓度的足量稀盐酸反应,是否也能得出同样结论?
(10)小刚与小红分别做相同质量的不同金属与同质量、同质量分数的稀H2SO4反应的实验,实验
结束后,分别交上的实验报告,并绘制出金属Zn、Fe分别与稀H2SO4反应放出H2的函数图象(如图所示).
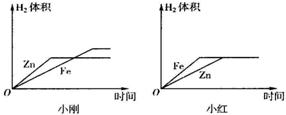
两个图象中存在有错误的是
图象不同的原因是
由该实验可以得到的结论:
①金属与酸反应的速率与
②金属与酸反应中若生成盐中金属价态相同,则生成的氢气量与
(11)将铁粉加到一定量的硝酸银、硝酸铜、硝酸锌的混合溶液中,充分反应后过滤,在滤液中滴加盐酸,没有白色沉淀生成,则滤渣中一定有
(12)现一块铜合金,可能是黄铜(铜锌合金)、青铜(铜、锡合金)、白铜[铜、镍(Ni)合金]中的一
种,现欲测定其组成.
[查阅资料]Ⅰ.锌、锡、镍皆能与稀硫酸发生置换反应,生成+2价的金属离子;
Ⅱ.相对原子质量Zn-65,Sn一119,Ni一59.
[实验步骤及数据]取5g合金粉碎后放入烧杯中,将20g15%稀H2SO4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
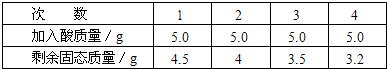
试求:①合金中铜的质量分数
查看习题详情和答案>>
(1)以下工具的制作过程中没有发生化学变化的是(
A
)A.原始人制作石刀;B.冶炼青铜;C.炼铁
(2)请将以下金属材料的冶炼按年代的先后顺序排序
B.A.C
(填序号).A.铁;B.青铜;C.铝
从以上顺序可以看出,金属制品的出现顺序与
金属活动性
有关,那么金属钾的制得应排在C
之后.(3)金属区别于非金属的主要物理性质是,金属具有
金属光泽
,金属区别于非金属的主要化学特征是良好的传热导电性
.在化学变化中金属原子通常表现为延展性易失去电子
.(4)孔雀石主要成分为碱式碳酸铜,经加热会发生反应:Cu2(OH)2CO3△2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:
2CuO+2C═2Cu+CO2↑
(5)古代术士将炉甘石(主要成分为ZnCO3)与赤铜矿(Cu2O)、木炭放在炼炉中高温灼烧,炼出金光灿灿的“黄金”,被称为“炼石成金”.
①请你用学过的知识回答,真的可以“炼石成金”吗?
不能,在化学变化过程中元素种类不可能发生改变
.②那么你认为这金光灿灿的金属是什么?它是怎么炼出来的?写出有关化学方程式
该金属可能是
铜锌合金
,炼出它的化学方程式为ZnCO3═ZnO+CO2↑
、2ZnO+C═2Zn+CO2↑
、2Cu2O+C═4Cu+CO2↑
.(6)到西汉时期我国的劳动人民又发明了“湿法炼铜”,在西汉刘安所著的《淮南万毕术》中就有“曾青得铁则化为铜”的记载(“曾青”是指铜的化合物),请用反应方程式表示其冶炼原理:
Fe+CuSO4═Cu+FeSO4
(7)磁悬浮的核心技术得制备超导材料.有一种超导材料的化学式为Y2BaCu6O10,它是以YmOn、BaCO3和CuO为原料经研磨烧结而成.假设此过程中所有元素的化合价不变,试填写以下空白:
a.超导材料Y2BaCu6O10是由
四
种元素组成的,YmOn的化学式是:Y2O3
b.在合成该超导材料的同时还生成-种产物,该物质是
CO2
(写化学式).金属的使用及冶炼历史也引起同学们极大兴趣,初三同学组织化学兴趣小组继续进行(8)(9)探究:
(8)首先他们收集大量有关钢铁的成语与民间谚语.其中有说明钢的性能比铁好的有
恨铁不成钢
,知道“百炼成钢”是指铁在高温条件下反复敲打发生的反应是:C+O2═CO2
,从而了解钢与铁的机械性能不同是因为两者含碳量不等
.(9)钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究.
[提出假设]a. Ti的金属活动性比Mg强;
b.Ti的金属活动性介于Mg和Ag之间.
[查阅资料]在相同条件下,金属与酸反应,产生气泡的速率越快,则该金属活动性越强.
[实验设计]同温下,取大小相同的这三种金属薄片,分别投入等体积、等浓度的足量稀盐酸中,观察现象.
请回答:三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是
除去氧化膜利于直接反应
.[实验现象]

[实验结论]原假设中
a
不正确,理由是镁反应速率比钛快
.[结论]用不同浓度的足量稀盐酸反应,是否也能得出同样结论?
否
,请说明理由反应速率与反应物浓度有关
(10)小刚与小红分别做相同质量的不同金属与同质量、同质量分数的稀H2SO4反应的实验,实验
结束后,分别交上的实验报告,并绘制出金属Zn、Fe分别与稀H2SO4反应放出H2的函数图象(如图所示).

两个图象中存在有错误的是
小红
的图象,判断错误的理由是图象中Fe与Zn标反了,Zn的反应速率较Fe快
,图象不同的原因是
小刚取的金属量较少,金属反应完,而小红取的酸量较少,酸完全反应完
.由该实验可以得到的结论:
①金属与酸反应的速率与
金属活动性
有关.②金属与酸反应中若生成盐中金属价态相同,则生成的氢气量与
相对原子质量
有关.(11)将铁粉加到一定量的硝酸银、硝酸铜、硝酸锌的混合溶液中,充分反应后过滤,在滤液中滴加盐酸,没有白色沉淀生成,则滤渣中一定有
Ag、Zn(NO3)2
,肯定滤液中有Fe(NO3)2
.(12)现一块铜合金,可能是黄铜(铜锌合金)、青铜(铜、锡合金)、白铜[铜、镍(Ni)合金]中的一
种,现欲测定其组成.
[查阅资料]Ⅰ.锌、锡、镍皆能与稀硫酸发生置换反应,生成+2价的金属离子;
Ⅱ.相对原子质量Zn-65,Sn一119,Ni一59.
[实验步骤及数据]取5g合金粉碎后放入烧杯中,将20g15%稀H2SO4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:

试求:①合金中铜的质量分数
64%
.②合金中另一金属为何种金属.另一种金属为锌
.