摘要:6.反应:CaCl2+CO2+H2O =CaCO3↓+2HCl在任何情况下都不能发生反应.原因是该反应( ) A.△H > 0 △S > 0 B.△H < 0 △S < 0 C.△H < 0 △S > 0 D.△H > 0 △S < 0
网址:http://m.1010jiajiao.com/timu3_id_304169[举报]
汉密尔顿.史密斯出生于1931年,不修边幅的他并不认为自己是一名世界级的科学家,自称是“厨房化学师”.“厨房化学”可以理解为利用家庭生活用品来做化学实验,对化学进行学习和研究的活动.某厨房内有一含NaCl、Na2CO3?10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数.

(1)实验时,B中发生反应的化学方程式为
(2)装置C、D中盛放的试剂分别为:C
(3)E装置中的仪器名称是
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将
(5)反应前,在B装置中通入空气可减少实验误差,操作方法是
查看习题详情和答案>>

(1)实验时,B中发生反应的化学方程式为
Na2CO3?10H2O
Na2CO3+10 H2O、2NaHCO3=Na2CO3+CO2↑+H2O
| ||
Na2CO3?10H2O
Na2CO3+10 H2O、2NaHCO3=Na2CO3+CO2↑+H2O
.
| ||
(2)装置C、D中盛放的试剂分别为:C
无水CaCl2
无水CaCl2
,D碱石灰
碱石灰
.(供选试剂为:浓硫酸、无水CaCl2、碱石灰)(3)E装置中的仪器名称是
干燥管
干燥管
,它在该实验中的主要作用是防止空气中的H2O和CO2进入D中
防止空气中的H2O和CO2进入D中
.(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将
偏低
偏低
(填“偏高”“偏低”或“无影响”).(5)反应前,在B装置中通入空气可减少实验误差,操作方法是
关闭弹簧夹b,打开弹簧夹a,向装置中通入空气
关闭弹簧夹b,打开弹簧夹a,向装置中通入空气
.Ⅰ、书写以下反应的化学方程式
(1)实验室制取氯气:
(2)实验室制取氨气:
(3)浓硫酸与木炭粉在加热条件下反应:
(4)铝与烧碱溶液反应:
(5)铜与浓硫酸的反应:
Ⅱ、书写以下反应的离子方程式
(1)氢氧化钡与稀硫酸反应的离子方程式:
(2)氧化铝与稀硫酸反应的离子方程式:
(3)二氧化碳与足量氢氧化钠溶液反应的离子方程式:
(4)金属钠投入水中反应的离子方程式:
(5)向氯化铁溶液加入足量铁粉后发生反应的离子方程式:
查看习题详情和答案>>
(1)实验室制取氯气:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
(2)实验室制取氨气:
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
(3)浓硫酸与木炭粉在加热条件下反应:
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
(4)铝与烧碱溶液反应:
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
(5)铜与浓硫酸的反应:
Cu+2H2SO4(浓)
CuSO4+2SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+2SO2↑+2H2O
| ||
Ⅱ、书写以下反应的离子方程式
(1)氢氧化钡与稀硫酸反应的离子方程式:
SO42-+Ba2++2OH-+2H+=2H2O+BaSO4↓
SO42-+Ba2++2OH-+2H+=2H2O+BaSO4↓
(2)氧化铝与稀硫酸反应的离子方程式:
Al2O3+6H+=2Al3++3H2O
Al2O3+6H+=2Al3++3H2O
(3)二氧化碳与足量氢氧化钠溶液反应的离子方程式:
CO2+2OH-=CO32-+H2O
CO2+2OH-=CO32-+H2O
(4)金属钠投入水中反应的离子方程式:
2Na+2H2O=2Na++2OH-+H2↑
2Na+2H2O=2Na++2OH-+H2↑
(5)向氯化铁溶液加入足量铁粉后发生反应的离子方程式:
Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:(1)用化学符号表示下列4种微粒:
A
H2O
H2O
;BNH3
NH3
;CNH4+
NH4+
;DOH-
OH-
.(2)写出A、B、E三种微粒反应的离子方程式:
Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+
Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+
.(Ⅱ)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:
请回答下列问题:
(1)D的化学式是
NH3
NH3
,E的化学式是NH4Cl
NH4Cl
.(2)A和B反应生成C的化学方程式是:
H2+Cl2
2HCl
| ||
H2+Cl2
2HCl
.
| ||
(3)E和F反应生成D、H和G的化学方程式是:
2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2
| ||
2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2
.
| ||
有一含NaCl、Na2CO3?10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数.

(1)实验时,B中发生反应的化学方程式为
(2)装置C、D中盛放的试剂分别为:C
(3)E装置中的仪器名称是
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将
(5)若样品的质量为m g,反应后C、D的质量差分别为m1g、m2g,则该混合物中Na2CO3?10H2O的质量分数为:
×100%
×100%(结果用分数表示,可不化简).
查看习题详情和答案>>

(1)实验时,B中发生反应的化学方程式为
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
,
| ||
Na2CO3?10H2O
Na2CO3+10H2O
| ||
Na2CO3?10H2O
Na2CO3+10H2O
.
| ||
(2)装置C、D中盛放的试剂分别为:C
无水CaCl2
无水CaCl2
,D碱石灰
碱石灰
(供选试剂为:浓硫酸、无水CaCl2、碱石灰)(3)E装置中的仪器名称是
球形干燥管
球形干燥管
,它在该实验中的主要作用是防止空气中的CO2和水蒸气进入影响测定结果
防止空气中的CO2和水蒸气进入影响测定结果
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将
偏低
偏低
(填“偏高”、“偏低”或“无影响”).(5)若样品的质量为m g,反应后C、D的质量差分别为m1g、m2g,则该混合物中Na2CO3?10H2O的质量分数为:
| 286(44m1-18m2) |
| 180×44m |
| 286(44m1-18m2) |
| 180×44m |
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
C+ K2Cr2O7+ → CO2↑+ K2SO4+ Cr2(SO4)3+ H2O
请完成并配平上述化学方程式.
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
①下列措施中有利于增大该反应的反应速率的是 ;
A、随时将CH3OH与反应混合物分离
B、降低反应温度
C、增大体系压强
D、使用高效催化剂
②已知:CO(g)+
O2(g)=CO2(g)△H2=-283 kJ?mol-1H2(g)+
O2(g)=H2O(g)△H3=-242 kJ?mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为 ;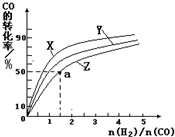
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是 ;
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g) 的平衡常数K= .
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 .
查看习题详情和答案>>
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
请完成并配平上述化学方程式.
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
①下列措施中有利于增大该反应的反应速率的是
A、随时将CH3OH与反应混合物分离
B、降低反应温度
C、增大体系压强
D、使用高效催化剂
②已知:CO(g)+
| 1 |
| 2 |
| 1 |
| 2 |
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为

③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g) 的平衡常数K=
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为