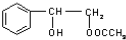
摘要:18.由苯乙烯(k^s#5*u)和羟基乙酸乙酯(k^s#5*u)组成的混合物中.氢元素的质量分数高^考#资*源#网为 A.4.6% B.7.7% C.15.6 % D.无法计算 第II卷
网址:http://m.1010jiajiao.com/timu3_id_301545[举报]
(2013?黄山一模)由苯乙烯经下列反应可制得F、K两种高分子化合物,它们都是常用的塑料.
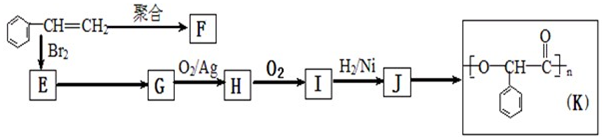
(1)J中所含官能团的名称为
(2)聚合物F的结构简式是
 ;I的分子式是
;I的分子式是
(3)E转化为G的化学方程式是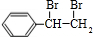 +2NaOH
+2NaOH
 +2NaBr
+2NaBr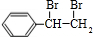 +2NaOH
+2NaOH
 +2NaBr;反应类型属于
+2NaBr;反应类型属于
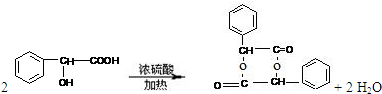
(4)在一定条件下,两分子J能脱去两分子水形成一种六元环状化合物,写出该化合物的结构简式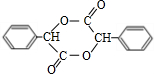
 .
.
(5)写出J 的一种符合下列条件的同分异构体X结简式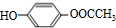
 .
.
①.1mol X可以与3mol NaOH反应 ②.X分子中氢原子核磁共振氢谱有4个峰.
查看习题详情和答案>>

(1)J中所含官能团的名称为
羟基、羧基
羟基、羧基
;K中所含官能团的结构简式为-COO-
-COO-
(2)聚合物F的结构简式是


C8H6O3
C8H6O3
.(3)E转化为G的化学方程式是
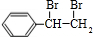 +2NaOH
+2NaOH| 水 |
| △ |
 +2NaBr
+2NaBr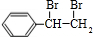 +2NaOH
+2NaOH| 水 |
| △ |
 +2NaBr
+2NaBr水解反应
水解反应
(4)在一定条件下,两分子J能脱去两分子水形成一种六元环状化合物,写出该化合物的结构简式


(5)写出J 的一种符合下列条件的同分异构体X结简式


①.1mol X可以与3mol NaOH反应 ②.X分子中氢原子核磁共振氢谱有4个峰.
由苯乙烯经下列反应可制得F、K两种高分子化合物,它们都是常用的塑料。
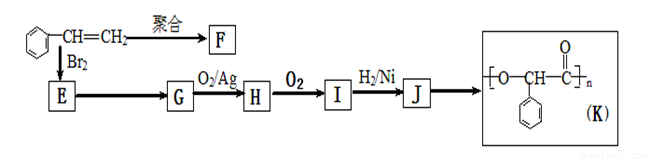
(1)J中所含官能团的名称为 ;K中所含官能团的结构简式为
(2)聚合物F的结构简式是 ;I的分子式是 。
(3)E转化为G的化学方程式是 ;反应类型属于
(4)在一定条件下,两分子J能脱去两分子水形成一种六元环状化合物,写出该化合物的结构简式 。
(5)写出J 的一种符合下列条件的同分异构体X结简式 。
①1mol X可以与3mol NaOH反应 ②X分子中氢原子核磁共振氢谱有4个峰,
查看习题详情和答案>>
【化学--选修2:化学与技术】自来水生产的流程示意图见下:

(1)混凝剂除去悬浮物质的过程
①只是物理变化 ②只是化学变化 ③是物理和化学变化
FeSO4?7H2O是常用的混凝剂,它在水中最终生成
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂填加时先加
(3)氯气消毒,是因为它与水反应生成了HClO,次氯酸的强氧化性能杀死水中的病菌(不能直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).
Cl2+H2O?HCl+HClO K=4.5×10-4
使用氯气为自来水消毒可以有效地控制次氯酸的浓度,请结合平衡常数解释原因:
①臭氧 ②NH3(液) ③K2FeO4 ④SO2
(4)有些地区的天然水中含有较多的钙、镁离子.用离子交换树脂软化硬水时,先后把水通过分别装有
(5)测定水中的溶解氧:量取40mL水样,迅速加入MnSO4和KOH混合溶液,再加入KI溶液,立即塞好塞子,振荡使完全反应.打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成.用0.010mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液.已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+.上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2 MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32-=2I-+S4O62-
则水中的溶解氧量为
查看习题详情和答案>>

(1)混凝剂除去悬浮物质的过程
③
③
(填写序号)①只是物理变化 ②只是化学变化 ③是物理和化学变化
FeSO4?7H2O是常用的混凝剂,它在水中最终生成
Fe(OH)3
Fe(OH)3
沉淀.(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂填加时先加
石灰
石灰
后加纯碱
纯碱
,原因是过量的钙离子可通过纯碱使之沉淀下来
过量的钙离子可通过纯碱使之沉淀下来
.(3)氯气消毒,是因为它与水反应生成了HClO,次氯酸的强氧化性能杀死水中的病菌(不能直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).
Cl2+H2O?HCl+HClO K=4.5×10-4
使用氯气为自来水消毒可以有效地控制次氯酸的浓度,请结合平衡常数解释原因:
由氯气与水反应的平衡常数可知,该反应的限度很小,生成的HClO浓度很小,且随着HClO的消耗,平衡会不断向正反应移动,补充HClO
由氯气与水反应的平衡常数可知,该反应的限度很小,生成的HClO浓度很小,且随着HClO的消耗,平衡会不断向正反应移动,补充HClO
.下列物质中,①③
①③
可以作为氯气的代用品(填写序号).①臭氧 ②NH3(液) ③K2FeO4 ④SO2
(4)有些地区的天然水中含有较多的钙、镁离子.用离子交换树脂软化硬水时,先后把水通过分别装有
阳
阳
离子交换树脂和阴
阴
离子交换树脂的离子交换柱(填“阴”或“阳”,阳离子交换树脂为HR型,阴离子交换树脂为R′OH型).(5)测定水中的溶解氧:量取40mL水样,迅速加入MnSO4和KOH混合溶液,再加入KI溶液,立即塞好塞子,振荡使完全反应.打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成.用0.010mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液.已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+.上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2 MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32-=2I-+S4O62-
则水中的溶解氧量为
12.0
12.0
mg?L-1.(2010?厦门二模)高温裂解法处理工业废硫酸的流程图如下:
废硫酸高温裂解的基本原理可用下列方程按两个阶段进行
H2SO4(1)
SO3(g)+H2O(g)△H=+176kJ?mol-1
2SO3(g)?2SO2(g)+O2(g)△H=+196k?mol-1
为研究废硫酸的雾化和裂解情况,有关实验数据如下
(1)由上表数据可得出的结论是
(2)废硫酸裂解成SO2总反应的热化学方程式为
(3)在催化氧化室中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ?mol-1
①某温度时,该反应的平衡常数K=3.5,平衡后再充入一定量气体测得.100L的恒容密闭容器中含有3.0molSO2,16.0mol O2和3.0mol SO3(g),此时平衡
②上述反应达到平衡后,改变下列条件,能使SO2平衡浓度比原来减小的是
A.保持温度和容器体积不变,充入1.0molO2
B.保持温度和容器内压强不变,充入3.0molN2
C.降低温度
D.在其他条件不变时,缩小容器的容积
(4)尾气SO2用饱和Na2SO3溶液吸收可得到一种化工原料,反应的化学方程式为
(5)科学家研究出以图所示装置用电化学原理生产硫酸的新工艺,其阳极的电极反应式为

查看习题详情和答案>>

废硫酸高温裂解的基本原理可用下列方程按两个阶段进行
H2SO4(1)
| 500-850℃ |
2SO3(g)?2SO2(g)+O2(g)△H=+196k?mol-1
为研究废硫酸的雾化和裂解情况,有关实验数据如下
| 雾化后废硫酸液滴直径 | 废硫酸完全裂解所需时间 | |
| 普通雾化器 | 800-1200/μm | 10s以上 |
| 旋转式雾化器 | 600-850 μm | 8-10s |
| 压缩风雾化器 | 400-650 μm | 6-7s |
| 超声波雾化器 | 100-300μm | 3.5-5s |
废硫酸液滴直径越小裂解速率越快
废硫酸液滴直径越小裂解速率越快
;(2)废硫酸裂解成SO2总反应的热化学方程式为
2H2SO4(l)═2SO2(g)+O2(g)+2H2O(g)△H=+548kJ?mol-1
2H2SO4(l)═2SO2(g)+O2(g)+2H2O(g)△H=+548kJ?mol-1
;(3)在催化氧化室中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ?mol-1
①某温度时,该反应的平衡常数K=3.5,平衡后再充入一定量气体测得.100L的恒容密闭容器中含有3.0molSO2,16.0mol O2和3.0mol SO3(g),此时平衡
向逆反应方向
向逆反应方向
移动;(填“向正反应方向”、“向逆反应方向”或“不”)②上述反应达到平衡后,改变下列条件,能使SO2平衡浓度比原来减小的是
A、C
A、C
;(填字母)A.保持温度和容器体积不变,充入1.0molO2
B.保持温度和容器内压强不变,充入3.0molN2
C.降低温度
D.在其他条件不变时,缩小容器的容积
(4)尾气SO2用饱和Na2SO3溶液吸收可得到一种化工原料,反应的化学方程式为
SO2+H=2O+Na2SO3═2NaHSO3
SO2+H=2O+Na2SO3═2NaHSO3
(5)科学家研究出以图所示装置用电化学原理生产硫酸的新工艺,其阳极的电极反应式为
SO2+2H2O-2e-=SO42-+4H+
SO2+2H2O-2e-=SO42-+4H+
,总反应的化学方程式为2SO2+O2+2H2O═2H2SO4
2SO2+O2+2H2O═2H2SO4
.
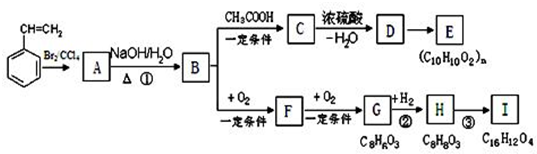
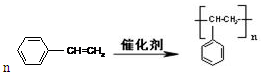
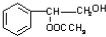 或
或