摘要:4.下列物质中.只含有共价键的化合物是 ( ) A.Na B.N2 C.CO2 D.KCl
网址:http://m.1010jiajiao.com/timu3_id_300734[举报]
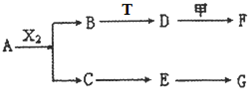 下列物质有如下转化关系(有的生成物未列出,反应条件均省略),其中:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色,D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
下列物质有如下转化关系(有的生成物未列出,反应条件均省略),其中:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色,D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.A、B、C、D、E均由Q、R、X、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍;R和X相邻;Q和T同主族,Q为非金属元素,T为金属元素.则:
(1)X在周期表中的位置是
第二周期,ⅥA族
第二周期,ⅥA族
,R、X、T的原子半径从小到大的顺序为:Na>N>O
Na>N>O
(用元素符号表示);T与X形成的化合物T2X2含有的化学键类型是:离子键、非极性共价键
离子键、非极性共价键
.(2)A和G等物质的量反应生成的产物的水溶液显
酸性
酸性
性,其原因用离子方程式表示为NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
;(3)A和X2反应的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
;金属甲与D溶液反应生成F的离子方程式为:
| ||
| △ |
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.(4)为保护环境,通过安装汽车尾气处理装置,使尾气中的E和一氧化碳反应转化为两种空气的成分,当有22.4L的E(标准状况)转化时,转移的电子数为
2.408×1024
2.408×1024
NA.下列说法正确的是( )
①具有规则几何外形的固体一定是晶体 ②NaCl晶体中与每个Na+距离相等且最近的Na+共有12个
③非极性分子中一定含有非极性键 ④晶格能由大到小:NaF>NaCl>NaBr>NaI
⑤含有共价键的晶体一定具有高的熔、沸点及硬度 ⑥s-s σ键与s-p σ键的电子云形状相同
⑦含有π键的化合物与只含σ键的化合物的化学性质不同 ⑧中心原子采取sp3杂化的分子,其立体构形不一定是正四面体.
①具有规则几何外形的固体一定是晶体 ②NaCl晶体中与每个Na+距离相等且最近的Na+共有12个
③非极性分子中一定含有非极性键 ④晶格能由大到小:NaF>NaCl>NaBr>NaI
⑤含有共价键的晶体一定具有高的熔、沸点及硬度 ⑥s-s σ键与s-p σ键的电子云形状相同
⑦含有π键的化合物与只含σ键的化合物的化学性质不同 ⑧中心原子采取sp3杂化的分子,其立体构形不一定是正四面体.
查看习题详情和答案>>
下列说法正确的是( )
A.氘原子中的质子数和中子数之比为1∶1
B.Na2O2、Na2O中均只含离子键
C.NH4Cl属于离子化合物,不含共价键
D.18 g重水(D2O)中含有的电子数为10 NA
查看习题详情和答案>>