摘要:等体积的0.1mol·L-1的醋酸与0.01mol·L-1的醋酸相比.下列各项中后者比前者小的是( ) A.c(OH-) B.n(CH3COOH) C. D.
网址:http://m.1010jiajiao.com/timu3_id_300030[举报]
下列说法正确的是
A.0.01mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,所得溶液中c(H+)=c(OH-)
B.氯水中离子浓度大小关系是:c(H+)>c(Cl-)>c(OH-)>c(ClO-)
C.25℃时,将pH=a的醋酸溶液稀释10倍后,溶液的pH=b,则a>b
D.25℃时,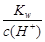 =0.1mol·L-1的溶液中,Na+、CO32-、Cl-一定能大量共存
=0.1mol·L-1的溶液中,Na+、CO32-、Cl-一定能大量共存
查看习题详情和答案>>
|
下列叙述中,正确的是 | |
A. |
中和10 mL 0.1mol·L-1醋酸与中和100 mL 0.01mol·L-1的醋酸所需同种碱溶液的量不同 |
B. |
等体积pH=3的酸溶液、pH=11的碱溶液相混合后,溶液的pH=7 |
C. |
体积相等,pH相等的盐酸和硫酸溶液中,H+离子的物质的量相等 |
D. |
pH=3的甲酸溶液的[H+]与pH=11的氨水溶液的[OH-]相等 |
常温下,下列叙述不正确的是
| A.pH=3弱酸溶液与pH=11的强碱溶液等体积混合后溶液呈酸性 |
| B.pH=5的硫酸溶液稀释到原来的500倍,稀释后c(SO42-)与c(H+)之比约为1:10 |
| C.0.1mol/L的Na2S溶液中粒子浓度关系:c(OH-)= c(HS-)+ 2c(H2S) +c(H+) |
| D.中和10mL 0.1mol/L 醋酸与100mL 0.01mol/L醋酸所需的NaOH物质的量不同 |
常温下,下列叙述不正确的是
A.pH=3弱酸溶液与pH=11的强碱溶液等体积混合后溶液呈酸性
B.pH=5的硫酸溶液稀释到原来的500倍,稀释后c(SO42-)与c(H+)之比约为1:10
C.0.1mol/L的Na2S溶液中粒子浓度关系:c(OH-)= c(HS-)+ 2c(H2S) +c(H+)
D.中和10mL 0.1mol/L 醋酸与100mL 0.01mol/L醋酸所需的NaOH物质的量不同
查看习题详情和答案>>
常温下,下列叙述不正确的是
| A.pH=3弱酸溶液与pH=11的强碱溶液等体积混合后溶液呈酸性 |
| B.pH=5的硫酸溶液稀释到原来的500倍,稀释后c(SO42-)与c(H+)之比约为1:10 |
| C.0.1mol/L的Na2S溶液中粒子浓度关系:c(OH-)= c(HS-)+ 2c(H2S) +c(H+) |
| D.中和10mL 0.1mol/L 醋酸与100mL 0.01mol/L醋酸所需的NaOH物质的量不同 |