网址:http://m.1010jiajiao.com/timu3_id_299962[举报]

(1)[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为:
(2)SO42-中硫原子的杂化轨道类型是
(3)某反应在超细铜粉做催化剂作用下生成
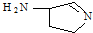 ,则分子中σ键与π键之比为
,则分子中σ键与π键之比为(4)该化合物[Cu(NH3)4]SO4中存在的化学键类型有
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
(5)NH4CuSO3中的金属阳离子的核外电子排布式为
(6)铜的某氯化物的晶胞结构如图
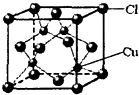 所示,该化合物的化学式为
所示,该化合物的化学式为 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.(1)超细铜粉的某制备方法如下:
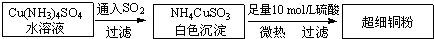
①[Cu(NH3)4]SO4中所含的化学键有
②NH4CuSO3中的金属阳离子的核外电子排布式为:
③NH3分子中N原子的杂化方式为:
④SO42-离子的空间构型为
(2)氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀.
①出上述制备CuCl的离子方程式:
| ||
| ||
②CuCl的晶胞结构如上图所示,其中Cl原子的配位数为
③CuCl的熔点比CuO的熔点
(10分)![]()
 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
![]()
(1)Cu位于元素周期表第I B族。Cu2+的核外电子排布式为__________
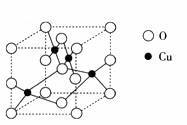
(2) 右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为_________。
(3)胆矾CuSO4?5H2O可写成[Cu(H2O4)]SO4 ?H2O,其结构示意图如下:
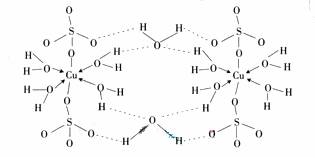
下列说法正确的是__________(填字母)。
A. 在上述结构示意图中,所有氧原子都采用sp3杂化
B. 在上述结构示意图中,存在配位键、共价键和离子键
C. 胆矾是分子晶体,分子间存在氢键
D. 胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______________。
(5)Cu2O的熔点比Cu2S的_________(填“高”或“低”),请解释原因__________。
查看习题详情和答案>>![]()
 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
![]()
(1) ![]() Cu位于元素周期表第I B族。Cu2+的核外电子排布式为__________。
Cu位于元素周期表第I B族。Cu2+的核外电子排布式为__________。
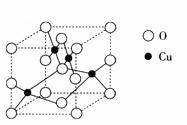
(2) ![]() 右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为_________。
右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为_________。
(3) ![]() 胆矾CuSO4?5H2O可写成[Cu(H2O4)]SO4 ?H2O,其结构示意图如下:
胆矾CuSO4?5H2O可写成[Cu(H2O4)]SO4 ?H2O,其结构示意图如下:
![]()
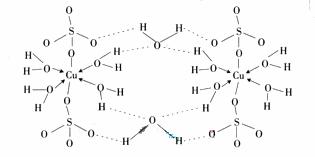
![]() 下列说法正确的是__________(填字母)。
下列说法正确的是__________(填字母)。
![]() A. 在上述结构示意图中,所有氧原子都采用sp3杂化
A. 在上述结构示意图中,所有氧原子都采用sp3杂化
![]() B. 在上述结构示意图中,存在配位键、共价键和离子键
B. 在上述结构示意图中,存在配位键、共价键和离子键
![]() C. 胆矾是分子晶体,分子间存在氢键
C. 胆矾是分子晶体,分子间存在氢键
![]() D. 胆矾中的水在不同温度下会分步失去
D. 胆矾中的水在不同温度下会分步失去
![]() (4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______________。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______________。
![]() (5)Cu2O的熔点比Cu2S的_________(填“高”或“低”),请解释原因__________。
(5)Cu2O的熔点比Cu2S的_________(填“高”或“低”),请解释原因__________。
![]()
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第I B族。Cu2+的核外电子排布式为 。
(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4 H2O,其结构示意图如下:

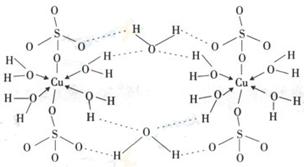
下列说法正确的是 (填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH2)2]2+配离子。已知NF3与NH3的空间构型都是三角锥形,单NF3不易与Cu2+形成配离子,其原因是 。
(5)Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因 。
查看习题详情和答案>>