摘要:在一定条件下反应:2A+B→2C.达到平衡 ①若升高温度.平衡向做移动.则正反应是 热反应, ②增加或减少B时.平衡不移动.则B是 态, ③若A.B.C都是气体.增加压强.平衡向 移动. (2)盐类水解的实质是 ; 在25℃时电离出的H+和OH-浓度为 ,其离子浓度乘积为 .此温度下PH=12的NaOH溶液中由水电离出的c(OH-)= ,FeCl3稀溶液呈.原因是 在配置Al2(SO4)3溶液时.为了防止发生水解.可以加入少量的 .盐碱地(含较多的NaCl.Na2CO3)不利于作物生长产生碱性的原因是
网址:http://m.1010jiajiao.com/timu3_id_299483[举报]
在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:2A(g)+B(g)?2C(g),达到平衡时B的浓度为0.1mol/L,则A的转化率为( )
查看习题详情和答案>>
 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题:(1)温度T1
>
>
T2(填“>”“=”或“<”).(2)正反应是
放热
放热
反应(填“吸热”或“放热”).(3)如果A、B、C均为气体,则m
>
>
2(填“>”“=”或“<”).(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强
增大
增大
(填“增大”“减小”或“不变”),平衡不
不
移动(填“向正反应方向”“向逆反应方向”或“不”).(5)已知2A(g)+B(g)?2C(g)△H=-a kJ?mol-1(a>0),在一个有催化剂的固定容积的容器中加入2mol A和1mol B,在500℃时充分反应达平衡后C的浓度为ω mol/L,放出热量b kJ.
①a
>
>
b(填“>”“=”或“<”).②若将反应温度升高到700℃,该反应的平衡常数将
减小
减小
(填“增大”“减小”或“不变”).③在上述容器中为使该反应的反应速率增大,且平衡向正反应方向移动的可采取的措施是
增大A2的浓度,或增大B2的浓度或同时增大A2、B2的浓度
增大A2的浓度,或增大B2的浓度或同时增大A2、B2的浓度
(说出一种即可)在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:2A(g)+B(g) 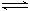 2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为( )
2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为( )
| A.67% | B.50% | C.25% | D.5% |
在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:
2A(g)+B(g) 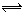 2C(g), 达到平衡时B的浓度为0.1mol/L,则A的转化率为 ( )
2C(g), 达到平衡时B的浓度为0.1mol/L,则A的转化率为 ( )
| A.67% | B.50% | C.25% | D.缺少条件无法计算 |
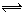 2C(g), 达到平衡时B的浓度为0.1mol/L,则A的转化率为 ( )
2C(g), 达到平衡时B的浓度为0.1mol/L,则A的转化率为 ( )