题目内容
在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:2A(g)+B(g)?2C(g),达到平衡时B的浓度为0.1mol/L,则A的转化率为( )
分析:依据题干条件,结合化学平衡的三段式列式计算,依据转化率等于消耗量除以起始量计算得到.
解答:解:平衡时B的物质的量为0.1mol/L×5L=0.5mol,则
2A(g)+B(g)?2C(g)
起始量(mol) 2 1 0
变化量(mol) 1 0.5 1
平衡量(mol) 1 0.5 1
则A的转化率=
×100%=50%,
故选B.
2A(g)+B(g)?2C(g)
起始量(mol) 2 1 0
变化量(mol) 1 0.5 1
平衡量(mol) 1 0.5 1
则A的转化率=
| 1mol |
| 2mol |
故选B.
点评:本题考查了化学平衡的计算应用,反应物转化率的计算应用,掌握三段式计算方法是解题关键,注意单位的统一,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:2A(g)+B(g) 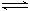 2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为( )
2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为( )
| A.67% | B.50% | C.25% | D.5% |
在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:
2A(g)+B(g) 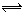 2C(g), 达到平衡时B的浓度为0.1mol/L,则A的转化率为 ( )
2C(g), 达到平衡时B的浓度为0.1mol/L,则A的转化率为 ( )
| A.67% | B.50% | C.25% | D.缺少条件无法计算 |
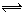 2C(g), 达到平衡时B的浓度为0.1mol/L,则A的转化率为 ( )
2C(g), 达到平衡时B的浓度为0.1mol/L,则A的转化率为 ( ) 2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为( )
2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为( )