摘要:在0.1mol/l的氨水中存在如下电离平衡: NH3 ·H2O NH4+ +OH-.改变下列条件.填写下表中的变化情况. 变化条件 一水合氨的电离平衡如何移动 导电能力 Kb 溶液pH 升高温度 加入少量NaOH固体 通入少量氯化氢气体 加入少量CH3COONH4固体
网址:http://m.1010jiajiao.com/timu3_id_299426[举报]
某氮肥厂氨氮废水中的氮元素多以NH4+和NH3?H2O的形式存在,该废水的处理流程如下:

(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收.
①用离子方程式表示加NaOH溶液的作用:
②用化学平衡原理解释通空气的目的:
(2)过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.两步反应的能量变化示意图如下:

①第一步反应是
②1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是:
查看习题详情和答案>>

(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收.
①用离子方程式表示加NaOH溶液的作用:
NH4++OH-═NH3?H2O
NH4++OH-═NH3?H2O
.②用化学平衡原理解释通空气的目的:
空气可以将生成的氨气带走,使化学平衡向正反应方向移动,促进了氨水电离
空气可以将生成的氨气带走,使化学平衡向正反应方向移动,促进了氨水电离
.(2)过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.两步反应的能量变化示意图如下:

①第一步反应是
放热
放热
反应(选题“放热”或“吸热”),判断依据是△H=-273kJ/mol<0(反应物的总能量大于生成物的总能量)
△H=-273kJ/mol<0(反应物的总能量大于生成物的总能量)
.②1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是:
NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol
NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol
. (2011?郑州二模)利用所学化学反应原理,解决以下问题:
(2011?郑州二模)利用所学化学反应原理,解决以下问题:(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、N
| H | + 4 |
| H | + 4 |
NH4Cl和NH3?H2O
NH4Cl和NH3?H2O
.(2)0.1mol?L-1的氨水与0.05mol?L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:
NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
. NH3?H2O+H+
NH3?H2O+H+(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是
R2Z>RX>RY
R2Z>RX>RY
.(4)以石墨电极电解100mL 0.1mol?L-1CuSO4溶液.若阳极上产生气体的物质的量为0.01mol,则阴极上析出Cu的质量为
0.64
0.64
g.(5)向20mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如图所示,B点溶液的pH=7(假设体积可以直接相加),则c(HCl)=
0.2
0.2
mol?L-1.(6)在温度、容积相同的3个密闭容器中,按下表投入反应物,发生反应(H2(g)+
I2(g)?2HI(g)△H=-14.9kJ?mol-1),在恒温、恒容条件下,测得反应达
到平衡时的数据如下表:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol H2、1mol I2 | 2 mol HI | 4 mol HI |
| HI的浓度(mol?L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 反应物转化率 | a1 | a2 | a3 |
AC
AC
.A.α1+α2=1 B.2α2=α3 C.a+b=14.9 D.c1=c2=c3.
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)一氧化碳在高温下与水蒸气反应的方程式为:CO+H2O=CO2+H2。已知部分物质燃烧的热化学方程式如下: 2H2(g) + O2(g)= 2H2O(l);△H=-571.6kJ·mol-1
2CO (g) + O2(g)= 2CO2 (g) ;△H=-566kJ·mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CO和水蒸气在高温催化剂下反应的热化学方程式 。
(3)在25℃下,向浓度均为0.1 mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学 式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式 。
(5)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=1的H2SO4溶液VaL与pH=11的NaOH溶液VbL混合,若所得混合液为 中性,则Va︰Vb= 。
中性,则Va︰Vb= 。
(6)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);
(7)NH4Cl是一种重要的化肥。
①用0.1 mol·L—1的盐酸滴定0.1 mol·L—1的氨水,滴定过程中不可能出现的结果是:
a.
b.
c.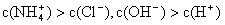
d.
②NH4Cl溶液中存在:NH4+ + H2O NH3·H2O + H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)
NH3·H2O + H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)
(1)合成氨反应N2(g)+3H2(g)
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。(2)一氧化碳在高温下与水蒸气反应的方程式为:CO+H2O=CO2+H2。已知部分物质燃烧的热化学方程式如下: 2H2(g) + O2(g)= 2H2O(l);△H=-571.6kJ·mol-1
2CO (g) + O2(g)= 2CO2 (g) ;△H=-566kJ·mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CO和水蒸气在高温催化剂下反应的热化学方程式 。
(3)在25℃下,向浓度均为0.1 mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学
 式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式 。
(5)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=1的H2SO4溶液VaL与pH=11的NaOH溶液VbL混合,若所得混合液为
 中性,则Va︰Vb= 。
中性,则Va︰Vb= 。(6)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);
(7)NH4Cl是一种重要的化肥。
①用0.1 mol·L—1的盐酸滴定0.1 mol·L—1的氨水,滴定过程中不可能出现的结果是:
a.

b.

c.
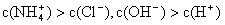
d.

②NH4Cl溶液中存在:NH4+ + H2O
 NH3·H2O + H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)
NH3·H2O + H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)(2010?北京)某氮肥厂氨氮废水中的氮元素多以NH4+和MH3?H2O的形式存在,该废水的处理流程如图1所示:
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收.
①用离子方程式表示加NaOH溶液的作用:
②用化学平衡原理解释通空气的目的:
(2)过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.两步反应的能量变化示意图如图2所示:
①第一步反应是
②1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2.若该反应消耗32g CH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是
查看习题详情和答案>>

(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收.
①用离子方程式表示加NaOH溶液的作用:
NH4++OH-=NH3?H2O
NH4++OH-=NH3?H2O
.②用化学平衡原理解释通空气的目的:
空气可以将生成的氨气带走,使化学平衡向正反应方向移动,促进了氨水电离
空气可以将生成的氨气带走,使化学平衡向正反应方向移动,促进了氨水电离
.(2)过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.两步反应的能量变化示意图如图2所示:
①第一步反应是
放热
放热
反应(选题“放热”或“吸热”),判断依据是△H=-273kJ/mol<0(反应为的总能量大于生成物的总能量)
△H=-273kJ/mol<0(反应为的总能量大于生成物的总能量)
.②1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是
NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol
NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol
.(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2.若该反应消耗32g CH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是
5:6
5:6
.