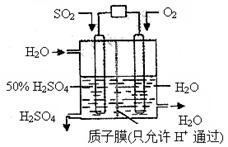
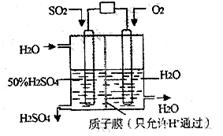
摘要:18.某研究组设想以如图所示装置用电化学原理生产硫酸.关于该装置的叙述正确的是 A.该装置为原电池.通入O2的电极是负极 B.该装置中.通入SO2的电极的电极反应式为:SO2-2e-+O2-+H2O=2H++SO42- C.该装置中.H+通过质子膜向左侧移动 D.在标准状况下.理论上若通入SO2速率为2.24 L·min-1.则通入O2速率应为1.12 L·min-1
网址:http://m.1010jiajiao.com/timu3_id_299093[举报]
某研究组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是

A.该装置为原电池,通入O2的电极是负极
B.该装置中,通入SO2的电极的电极反应式为:SO2-2e-+O2-+H2O=2H++SO42-
C.该装置中,H+通过质子膜向左侧移动
D.在标准状况下,理论上若通入SO2速率为2.24 L·min-1,则通入O2速率应为1.12 L·min-1
查看习题详情和答案>>
某研究组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是


| A.该装置为原电池,通入O2的电极是负极 |
| B.该装置中,通入SO2的电极的电极反应式为:SO2+O2-+H2O -2e- =2H++SO42- |
| C.该装置中,H+通过质子膜向左侧移动 |
| D.在标准状况下,理论上每消耗11.2L SO2,则可产生0.5mol H2SO4 |
某研究组设想以如图所示装置用电化学原理生产硫酸.关于该装置的叙述正确的是( )

查看习题详情和答案>>
| A.该装置为原电池,通入O2的电极是负极 |
| B.该装置中,通入SO2的电极的电极反应式为:SO2+O2-+H2O-2e-=2H++SO42- |
| C.该装置中,H+通过质子膜向左侧移动 |
| D.在标准状况下,理论上每消耗11.2LSO2,则可产生0.5molH2SO4 |