摘要:能使铁变成Fe3O4的常见氧化剂是 .
网址:http://m.1010jiajiao.com/timu3_id_298768[举报]
硫酸的消费量常被视为一个国家工业发达水平的标志.我国主要以黄铁矿(FeS2)为原料采用接触法生产硫酸.其主要涉及到的反应有(没有配平)A.FeS2+O2→Fe2O3+SO2 B. SO2(g)+O2 (g)→SO3(g) C.SO3+H2O→H2SO4
回答下列问题:
(1)已知FeS2与足量氧气反应生成1molSO2时放出426.5kJ的热量.则其反应的热化学方程式为
(2)已知某温度时反应B的平衡常数为800.在体积恒为10L的密闭容器中充入10mol SO2、30mol O2和10mol SO3,反应开始将向
A.容器内压强不变 B.混合气体的密度不变 C.v正(SO2)=2v正(O2)
D.c(SO2):c(O2):c(SO3)=2:1:2 E.混合气体的摩尔质量不变
(3)反应A的副产物Fe2O3是铁锈的主要成分.N2H4(肼)能使锅炉内壁的铁锈(主要成分Fe2O3)变成磁性氧化铁(Fe3O4)层,可以减缓锅炉锈蚀.若反应过程中肼转化为氮气,每生成1mol Fe3O4,转移电子的物质的量为
(4)铁盐溶液可以洗涤做过银镜实验的试管,原理是Fe3++Ag(s)?Fe2++Ag+.甲同学将银粉加入到Fe2(SO4)3溶液中进行了实验,观察到的现象是
(5)用10mol/L的浓硫酸配制2mol/L的稀硫酸,所用的玻璃仪器除量筒和玻璃棒外,还有
A.容量瓶 B.烧杯 C.烧瓶 D.胶头滴管.
查看习题详情和答案>>
回答下列问题:
(1)已知FeS2与足量氧气反应生成1molSO2时放出426.5kJ的热量.则其反应的热化学方程式为
4FeS2(s)+11O2(g)
2Fe2O3(s)+8SO2(g)△H=-3412kJ/mol
| ||
4FeS2(s)+11O2(g)
2Fe2O3(s)+8SO2(g)△H=-3412kJ/mol
.
| ||
(2)已知某温度时反应B的平衡常数为800.在体积恒为10L的密闭容器中充入10mol SO2、30mol O2和10mol SO3,反应开始将向
正
正
(填“正”或“逆”)方向进行.在该容器中,能说明该反应已达到平衡状态的依据是A、E
A、E
(填字母序号)A.容器内压强不变 B.混合气体的密度不变 C.v正(SO2)=2v正(O2)
D.c(SO2):c(O2):c(SO3)=2:1:2 E.混合气体的摩尔质量不变
(3)反应A的副产物Fe2O3是铁锈的主要成分.N2H4(肼)能使锅炉内壁的铁锈(主要成分Fe2O3)变成磁性氧化铁(Fe3O4)层,可以减缓锅炉锈蚀.若反应过程中肼转化为氮气,每生成1mol Fe3O4,转移电子的物质的量为
1mol
1mol
,需要消耗肼的质量为8
8
g.(4)铁盐溶液可以洗涤做过银镜实验的试管,原理是Fe3++Ag(s)?Fe2++Ag+.甲同学将银粉加入到Fe2(SO4)3溶液中进行了实验,观察到的现象是
银粉逐渐溶解,溶液由棕黄色逐渐变为浅绿色,溶液出现白色沉淀
银粉逐渐溶解,溶液由棕黄色逐渐变为浅绿色,溶液出现白色沉淀
.丙同学认为向试管中加入几块铅笔芯也有利于除去银,你认为他的理由是银与铅笔中的石墨在溶液中形成了原电池,银为负极,石墨为正极,加快了反应速率
银与铅笔中的石墨在溶液中形成了原电池,银为负极,石墨为正极,加快了反应速率
.(5)用10mol/L的浓硫酸配制2mol/L的稀硫酸,所用的玻璃仪器除量筒和玻璃棒外,还有
A、B、D
A、B、D
A.容量瓶 B.烧杯 C.烧瓶 D.胶头滴管.
高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾步骤为:称取一定质量的KCl、NaClO4溶解,然后混合,经冷却、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到(有关物质溶解度与温度的关系见表).
(l)用蒸馏水多次洗涤滤渣的目的是: .
(2)Fe和KCl04反应放出的热量,能为熔融盐电池提供550-660℃的温度,使低熔点盐熔化导电,从而激活电池.这类电池称为热电池.Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,该电池工作时,电池总反应为:
(3)已知Fe和KCl04作为热电池加热材料的供热原理为:
KClO4(s)+4Fe(s)=KCl(s)+4FeO(s),△H<0.
①在600℃测得产物中有Fe0、Fe304两种氧化物,猜想由Fe0转变成Fe3O4的化学方程式为: .
②称取一定质量上述加热材料反应后的混合物(假定只含氯化钾一种钾盐)于烧杯中,用蒸馏水充分洗涤、过滤、干澡,固体质量减少了0.43g,在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0棕色固体.计算该加热材料反应前,铁的质量为 g,KClO4的质量分数为 (写出计算过程).
查看习题详情和答案>>
| 溶解度 温度 化学式 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| KClO4 | 0.76 | 1.06 | 1.68 | 2.56 | 3.73 |
| KCl | 28 | 31.2 | 34.2 | 37.2 | 40.1 |
| NaClO4 | 167 | 183 | 201 | 222 | 245 |
(2)Fe和KCl04反应放出的热量,能为熔融盐电池提供550-660℃的温度,使低熔点盐熔化导电,从而激活电池.这类电池称为热电池.Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,该电池工作时,电池总反应为:
(3)已知Fe和KCl04作为热电池加热材料的供热原理为:
KClO4(s)+4Fe(s)=KCl(s)+4FeO(s),△H<0.
①在600℃测得产物中有Fe0、Fe304两种氧化物,猜想由Fe0转变成Fe3O4的化学方程式为:
②称取一定质量上述加热材料反应后的混合物(假定只含氯化钾一种钾盐)于烧杯中,用蒸馏水充分洗涤、过滤、干澡,固体质量减少了0.43g,在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0棕色固体.计算该加热材料反应前,铁的质量为
 常温下,在没有氧气存在时,铁粉与水几乎不反应,但在高温下,铁粉能与水蒸气反应.
常温下,在没有氧气存在时,铁粉与水几乎不反应,但在高温下,铁粉能与水蒸气反应.(1)铁粉与水蒸气反应的化学方程式是
Fe3O4+4H2O
3Fe+4H2
| ||
Fe3O4+4H2O
3Fe+4H2
.
| ||
(2)停止反应,待装置冷却后,取出反应后的混合物,加入过量的稀硫酸充分反应,过滤.简述检验所得滤液中含有Fe3+的操作方法:
取少量滤液与试管中,滴入几滴KSCN溶液,若溶液变血红色,证明含有铁离子,否则无铁离子
取少量滤液与试管中,滴入几滴KSCN溶液,若溶液变血红色,证明含有铁离子,否则无铁离子
.(3)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得的产物中不含+3价的铁.原因是(结合化学方程式说明)
如果反应后的混合物中含有过量的铁粉,会发生反应2Fe3++Fe=3Fe2+,铁粉把铁离子全部还原为亚铁离子后滴入KSCN溶液不变红色
如果反应后的混合物中含有过量的铁粉,会发生反应2Fe3++Fe=3Fe2+,铁粉把铁离子全部还原为亚铁离子后滴入KSCN溶液不变红色
.(4)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色.
①沉淀由白色变为红褐色的化学反应方程式是
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.②为了得到白色的Fe(OH)2沉淀,并尽可能较长时间保持白色沉淀,该同学设计了如图所示的装置:
请简述实验操作:
实验时先打开活塞K,再将分液漏斗的活塞打开,使稀硫酸与铁粉反应,用生成的氢气排出装置中的空气,然后关闭K,利用生成的氢气将试管中的硫酸亚铁溶液压入氢氧化钠溶液中,则可在盛氢氧化钠溶液的试剂瓶中较长时间保存白色氢氧化亚铁沉淀;
实验时先打开活塞K,再将分液漏斗的活塞打开,使稀硫酸与铁粉反应,用生成的氢气排出装置中的空气,然后关闭K,利用生成的氢气将试管中的硫酸亚铁溶液压入氢氧化钠溶液中,则可在盛氢氧化钠溶液的试剂瓶中较长时间保存白色氢氧化亚铁沉淀;
.
某同学创新设计制备氢氧化亚铁的实验方案:
(一)查阅资料
资料1:乙醇不与氢氧化钠或硫酸亚铁反应;乙醇与水互溶,氢氧化钠能溶于乙醇;硫酸亚铁在乙醇中的溶解度比在水中的溶解度小.氮气不能与铜反应.
资料2:几种含铁物质的颜色
(二)实验步骤及现象
①取少量的新制硫酸亚铁晶体于大试管中,向其中加入5mL热蒸馏水,使之充分溶解,然后向其中慢慢加入10mL无水乙醇,这时会发现溶液中有小气泡逸出,静置,直到无小气泡冒出为止.
②另取一支试管,向其中加入半药匙固体氢氧化钠,然后向其中加入5mL无水乙醇,充分溶解后静置.
③用长胶头滴管吸取新配制的氢氧化钠的乙醇溶液,伸入硫酸亚铁溶液中,慢慢地挤压橡胶头,连续吸取几次,使之充分反应,静置片刻,这时在试管底会有大量的白色凝乳状溶胶沉降.
④小心地倒去上层溶液,再向试管中加入3mL无水乙醇洗涤,连续洗涤两三次,这时白色的凝乳状溶胶会变成白色固体,然后倒在滤纸上使乙醇充分挥发,便得到白色固体粉末.
(1)为避免硫酸亚铁在溶于水的过程中被氧化,通常可以向溶液中加入 .向硫酸亚铁溶液中慢慢加入无水乙醇时,产生气泡的原因是 .某同学制备无水乙醇的方法是向无水乙醇(含乙醇的质量分数为99.5%以上)中加入一定量的氯化钙,然后蒸馏得到无水乙醇,你认为此方法能否得到无水乙醇? (填“能”或“否”).
(2)预测上述白色固体的成分可能是 ,保持白色的主要原因是 .
(3)写出生成白色沉淀的化学方程式: .
(三)探究产物成分
Ⅰ利用如图所示装置检验白色粉末的性质:
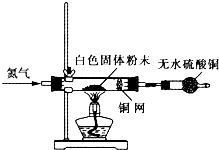
先通入氮气排尽装置内的空气后,继续通入氮气,然后加热硬质试管,观察到无水硫酸铜逐渐变成蓝色;硬质试管里的白色固体粉末逐渐变成黑色;铜网没有明显的颜色变化.当白色固体粉末全部变成黑色粉末时,停止加热,继续通入氮气至硬质试管冷却.
Ⅱ.待冷却后,取适量黑色粉末溶于少量的稀盐酸中,黑色粉末溶解,溶液呈浅绿色,不产生气泡.
Ⅲ.取Ⅱ中的溶液于试管中,滴加酸性高锰酸钾溶液,溶液的紫色褪去.
(4)实验1中,氮气的作用是 ,铜网的作用是 .
(5)证明白色固体粉末中含有+2价铁的实验现象为 :写出符合要求的方程式: .
属于分解反应的化学方程式: ;属于氧化还原反应的离子方程式:
(6)某同学在上述实验的基础上,增加了一个实验确认白色固体中不含+3价铁,设计的实验可能是 .
查看习题详情和答案>>
(一)查阅资料
资料1:乙醇不与氢氧化钠或硫酸亚铁反应;乙醇与水互溶,氢氧化钠能溶于乙醇;硫酸亚铁在乙醇中的溶解度比在水中的溶解度小.氮气不能与铜反应.
资料2:几种含铁物质的颜色
| 化学式 | Fe | FeO | Fe2O3 | Fe3O4 | Fe(OH)2 | Fe(OH)3 |
| 颜色 | 银白色 | 黑色 | 红色 | 黑色 | 白色 | 红褐色 |
①取少量的新制硫酸亚铁晶体于大试管中,向其中加入5mL热蒸馏水,使之充分溶解,然后向其中慢慢加入10mL无水乙醇,这时会发现溶液中有小气泡逸出,静置,直到无小气泡冒出为止.
②另取一支试管,向其中加入半药匙固体氢氧化钠,然后向其中加入5mL无水乙醇,充分溶解后静置.
③用长胶头滴管吸取新配制的氢氧化钠的乙醇溶液,伸入硫酸亚铁溶液中,慢慢地挤压橡胶头,连续吸取几次,使之充分反应,静置片刻,这时在试管底会有大量的白色凝乳状溶胶沉降.
④小心地倒去上层溶液,再向试管中加入3mL无水乙醇洗涤,连续洗涤两三次,这时白色的凝乳状溶胶会变成白色固体,然后倒在滤纸上使乙醇充分挥发,便得到白色固体粉末.
(1)为避免硫酸亚铁在溶于水的过程中被氧化,通常可以向溶液中加入
(2)预测上述白色固体的成分可能是
(3)写出生成白色沉淀的化学方程式:
(三)探究产物成分
Ⅰ利用如图所示装置检验白色粉末的性质:

先通入氮气排尽装置内的空气后,继续通入氮气,然后加热硬质试管,观察到无水硫酸铜逐渐变成蓝色;硬质试管里的白色固体粉末逐渐变成黑色;铜网没有明显的颜色变化.当白色固体粉末全部变成黑色粉末时,停止加热,继续通入氮气至硬质试管冷却.
Ⅱ.待冷却后,取适量黑色粉末溶于少量的稀盐酸中,黑色粉末溶解,溶液呈浅绿色,不产生气泡.
Ⅲ.取Ⅱ中的溶液于试管中,滴加酸性高锰酸钾溶液,溶液的紫色褪去.
(4)实验1中,氮气的作用是
(5)证明白色固体粉末中含有+2价铁的实验现象为
属于分解反应的化学方程式:
(6)某同学在上述实验的基础上,增加了一个实验确认白色固体中不含+3价铁,设计的实验可能是
(2009?广东模拟)在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应.请设计实验,证明还原铁粉与水蒸气能够发生反应.
(1)铁粉与水蒸气反应的化学方程式是:
(2)证明还原铁粉与水蒸气发生了反应的方法是
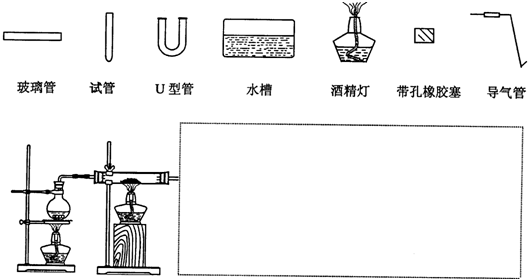
(3)某同学用如图所示装置进行实验,请帮助该同学完成设计,用下列简图画出未完成的实验装置示意图(铁架台可省略,导气管的形状可根据需要选择)
(4)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤.若混合物中既有Fe2+又有Fe3+,则证明该结论的实验方法是:
(5)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含+3价的Fe元素.原因是(结合离子方程式说明)
(6)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色.
①沉淀由白色→红褐色的化学方程式是:
②为了得到白色的Fe(OH)2沉淀,并尽可能长时间保持其白色,可采取的措施有多种,请写出其中的一种.
查看习题详情和答案>>
(1)铁粉与水蒸气反应的化学方程式是:
3Fe+4H2O(g)
Fe3O4+4H2↑
| ||
3Fe+4H2O(g)
Fe3O4+4H2↑
| ||
(2)证明还原铁粉与水蒸气发生了反应的方法是
检验是否有H2产生
检验是否有H2产生
(3)某同学用如图所示装置进行实验,请帮助该同学完成设计,用下列简图画出未完成的实验装置示意图(铁架台可省略,导气管的形状可根据需要选择)

(4)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤.若混合物中既有Fe2+又有Fe3+,则证明该结论的实验方法是:
各取少量溶液于两试管中,向其中一试管中滴入几滴KSCN溶液,向另一试管中加入高锰酸钾酸性溶液,观察溶液颜色变化,若前者溶液颜色变红,后是溶液紫红色褪去,则说明溶液中既有Fe2+又有Fe3+
各取少量溶液于两试管中,向其中一试管中滴入几滴KSCN溶液,向另一试管中加入高锰酸钾酸性溶液,观察溶液颜色变化,若前者溶液颜色变红,后是溶液紫红色褪去,则说明溶液中既有Fe2+又有Fe3+
(5)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含+3价的Fe元素.原因是(结合离子方程式说明)
如果反应后混合物中的铁粉过量,铁粉将溶液中的Fe3+全部还原为Fe2+,即便加KSCN溶液也不变红色.反应的离子方程式为Fe+2Fe3+=3Fe2+
如果反应后混合物中的铁粉过量,铁粉将溶液中的Fe3+全部还原为Fe2+,即便加KSCN溶液也不变红色.反应的离子方程式为Fe+2Fe3+=3Fe2+
(6)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色.
①沉淀由白色→红褐色的化学方程式是:
4Fe(OH)2+O2+2H2O═4Fe(OH)3
4Fe(OH)2+O2+2H2O═4Fe(OH)3
.②为了得到白色的Fe(OH)2沉淀,并尽可能长时间保持其白色,可采取的措施有多种,请写出其中的一种.
第一种:用一只容器较大针孔较细的注射器吸取滤液后再吸入NaOH溶液,然后倒置2~3次;
第二种:向滤液中加入植物油,使滤液与空气隔绝,然后再将滴管伸入水溶液中滴加氢氧化钠溶液;
第三种:向热的硫酸亚铁溶液中滴加热的氢氧化钠溶液,减少溶液中氧气的含量.
第二种:向滤液中加入植物油,使滤液与空气隔绝,然后再将滴管伸入水溶液中滴加氢氧化钠溶液;
第三种:向热的硫酸亚铁溶液中滴加热的氢氧化钠溶液,减少溶液中氧气的含量.
第一种:用一只容器较大针孔较细的注射器吸取滤液后再吸入NaOH溶液,然后倒置2~3次;
第二种:向滤液中加入植物油,使滤液与空气隔绝,然后再将滴管伸入水溶液中滴加氢氧化钠溶液;
第三种:向热的硫酸亚铁溶液中滴加热的氢氧化钠溶液,减少溶液中氧气的含量.
.第二种:向滤液中加入植物油,使滤液与空气隔绝,然后再将滴管伸入水溶液中滴加氢氧化钠溶液;
第三种:向热的硫酸亚铁溶液中滴加热的氢氧化钠溶液,减少溶液中氧气的含量.