题目内容
高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾步骤为:称取一定质量的KCl、NaClO4溶解,然后混合,经冷却、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到(有关物质溶解度与温度的关系见表).
(l)用蒸馏水多次洗涤滤渣的目的是: .
(2)Fe和KCl04反应放出的热量,能为熔融盐电池提供550-660℃的温度,使低熔点盐熔化导电,从而激活电池.这类电池称为热电池.Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,该电池工作时,电池总反应为:
(3)已知Fe和KCl04作为热电池加热材料的供热原理为:
KClO4(s)+4Fe(s)=KCl(s)+4FeO(s),△H<0.
①在600℃测得产物中有Fe0、Fe304两种氧化物,猜想由Fe0转变成Fe3O4的化学方程式为: .
②称取一定质量上述加热材料反应后的混合物(假定只含氯化钾一种钾盐)于烧杯中,用蒸馏水充分洗涤、过滤、干澡,固体质量减少了0.43g,在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0棕色固体.计算该加热材料反应前,铁的质量为 g,KClO4的质量分数为 (写出计算过程).
| 溶解度 温度 化学式 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| KClO4 | 0.76 | 1.06 | 1.68 | 2.56 | 3.73 |
| KCl | 28 | 31.2 | 34.2 | 37.2 | 40.1 |
| NaClO4 | 167 | 183 | 201 | 222 | 245 |
(2)Fe和KCl04反应放出的热量,能为熔融盐电池提供550-660℃的温度,使低熔点盐熔化导电,从而激活电池.这类电池称为热电池.Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,该电池工作时,电池总反应为:
(3)已知Fe和KCl04作为热电池加热材料的供热原理为:
KClO4(s)+4Fe(s)=KCl(s)+4FeO(s),△H<0.
①在600℃测得产物中有Fe0、Fe304两种氧化物,猜想由Fe0转变成Fe3O4的化学方程式为:
②称取一定质量上述加热材料反应后的混合物(假定只含氯化钾一种钾盐)于烧杯中,用蒸馏水充分洗涤、过滤、干澡,固体质量减少了0.43g,在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0棕色固体.计算该加热材料反应前,铁的质量为
分析:(1)用蒸馏水多次洗涤晶体的目的是洗去晶体表面的杂质;
(2)依据题干信息和质量守恒配平写出电池反应;
(3)①依据反应物和产物结合原子守恒写出化学方程式;
②由KClO4(s)+4Fe(s)═KCl(s)+4FeO(s)可知反应中KClO4和氯化钾物质的量相同,质量减少为氯化钾质量,红棕色固体为Fe2O3,铁的质量可以依据元素守恒来解答;
(2)依据题干信息和质量守恒配平写出电池反应;
(3)①依据反应物和产物结合原子守恒写出化学方程式;
②由KClO4(s)+4Fe(s)═KCl(s)+4FeO(s)可知反应中KClO4和氯化钾物质的量相同,质量减少为氯化钾质量,红棕色固体为Fe2O3,铁的质量可以依据元素守恒来解答;
解答:解:(1)用蒸馏水多次洗涤晶体的目的是洗去晶体表面的可溶性的杂质如钠离子、氯离子等,
故答案为:尽可能除去溶解度较大的杂质;
( 2 ) Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,该电池工作时失电子的做负极发生氧化反应,得到电子的发生还原反应,电池反应为:FeS2+4Li═Fe+2Li2S,
故答案为:FeS2+4Li═Fe+2Li2S;
(3)①600℃时FeO可部分分解生成Fe3O4,依据元素守恒计算得到出生成Fe3O4外还有Fe,依据原子守恒配平可得4FeO=Fe3O4+Fe,
故答案为:4FeO=Fe3O4+Fe;
②根据反应KClO4(s)+4Fe(s)═KCl(s)+4FeO(s),用蒸馏水充分洗涤、过滤、干燥,固体质量减少了0.43g,减少的固体质量是氯化钾的质量,n(KClO4)=n(KCl)=
,m(KClO4)=n(KClO4)×138.5 g?mol-1=
×138.5 g?mol-1=0.80g,
在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0g棕色固体.固体是Fe2O3,n(Fe)=2n(Fe2O3),得到:m(Fe)=n(Fe)×56 g?mol-1=
×2×56 g?mol-1=4.2g,则样品的总质量为0.80g+4.2g=5.0g,所以ω(KClO4)=
×100%=16%;
故答案为:4.2g;16%;
故答案为:尽可能除去溶解度较大的杂质;
( 2 ) Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,该电池工作时失电子的做负极发生氧化反应,得到电子的发生还原反应,电池反应为:FeS2+4Li═Fe+2Li2S,
故答案为:FeS2+4Li═Fe+2Li2S;
(3)①600℃时FeO可部分分解生成Fe3O4,依据元素守恒计算得到出生成Fe3O4外还有Fe,依据原子守恒配平可得4FeO=Fe3O4+Fe,
故答案为:4FeO=Fe3O4+Fe;
②根据反应KClO4(s)+4Fe(s)═KCl(s)+4FeO(s),用蒸馏水充分洗涤、过滤、干燥,固体质量减少了0.43g,减少的固体质量是氯化钾的质量,n(KClO4)=n(KCl)=
| 0.43g |
| 74.5g/mol |
| 0.43g |
| 74.5g/mol |
在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0g棕色固体.固体是Fe2O3,n(Fe)=2n(Fe2O3),得到:m(Fe)=n(Fe)×56 g?mol-1=
| 6.0g |
| 160g/mol |
| 0.80g |
| 5.0g |
故答案为:4.2g;16%;
点评:本题考查了物质制备反应的应用,化学方程式的书写,数据分析应用,溶解度变化的反应原理以及化学计算,题目难度较大.

练习册系列答案
相关题目
 高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.
高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.
(1)写出实验室制取高氯酸钾的化学方程式:______.
(2)用蒸馏水多次洗涤晶体的目的是______.
(3)称取29.8gKCl和34.0gNaNO3放入250mL烧杯中,再加入70.0g蒸馏水,制备KNO3晶体,I,使固体全部溶解.II,在100°C时蒸发掉50.0g水,维持该温度,趁热过滤析出晶体m1g.III,冷却结晶:待滤液冷却至室温(实验时室温为10°C)后,进行减压过滤.得KNO3粗产品m2g.IV,重结晶得KNO3纯品m3g.
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
| NaNO3 | KNO3 | NaCl | KCl | |
| 10°C | 80.5 | 20.9 | 35.7 | 31.0 |
| 100°C | 175 | 246 | 39.1 | 56.6 |
②该装置有三处错误,分别是______,
③若实验过程中发现倒吸现象,应采取的措施是______.
(4)KNO3晶体纯品的产率______.
高氯酸钾广泛用于火箭及热电池业。实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到。
(1)写出实验室制取高氯酸钾的化学方程式:___ _。
(2)用蒸馏水多次洗涤晶体的目的是______________ __。
(3)称取29.8gKCl和34.0gNaNO3放入250mL烧杯中,再加入70.0g蒸馏水,制备KNO3晶体, I、使固体全部溶解。II、在100oC时蒸发掉50.0g水,维持该温度,趁热过滤析出晶体![]() 。III、冷却结晶:待滤液冷却至室温(实验时室温为10oC)后,进行减压过滤。得KNO3粗产品
。III、冷却结晶:待滤液冷却至室温(实验时室温为10oC)后,进行减压过滤。得KNO3粗产品![]() 。IV、重结晶得KNO3纯品
。IV、重结晶得KNO3纯品![]() 。
。
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
| NaNO3 | KNO3 | NaCl | KCl | |
| 10oC | 80.5 | 20.9 | 35.7 | 31.0 |
| 100oC | 175 | 246 | 39.1 | 56.6 |
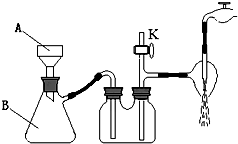
①操作III中采用减压过滤,装置如右图所示,仪器A和B的名称分别是
,
②该装置有三处错误,分别是
,
③若实验过程中发现倒吸现象,应采取的措施是 。
(4) KNO3晶体纯品的产率 。 
 高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.
高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.