网址:http://m.1010jiajiao.com/timu3_id_298460[举报]
(1)E2F的水溶液呈
(2)工业上电解EG的水溶液的离子化学方程式是:
(3)1molFD2在一定条件下与D2完全反应生成气态化合物放出98.3KJ热量,写出其热化学方程式:
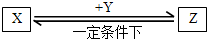
(4)下列变化中(如图)的物质均为上述七种元素间形成的单质或化合物间的变化,某些反应条件及某些物质已略去,请按要求写一例化学方程式或回答有关问题.
①若X、Y均为气态氢化物,则X与Y反应的化学方程式是
②若X、Y均为组成元素相同的酸式盐,则X与Y反应的化学方程式是
③若X、Y均不属于盐类,但两者组成元素相同(均含四种元素),其相对分子质量之差为14,且两者既能与NaOH溶液反应,又能与盐酸反应.则X、Y中相对分子质量最小的物质是
下列所述各微粒都是由短周期元素组成的.
(1)由两种短周期元素组成的A、B两种分子,分子中电子总数均为18且相对分子质量相同.若A、B能发生氧化还原反应,生成黄色固体单质.请写出该反应的化学方程式________;反应中若生成1 mol该单质,则转移电子的个数为________.
(2)有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38.W与Z同周期;W和Y不属于同一主族;Y元素原子最外层电子数占核外电子总数的3/4;W元素原子最外层电子数比Z元素的最外层电子数多5个电子.请写出由Z、W两种元素组成的化合物的电子式________.由X、Y按原子个数比为1∶1组成的化合物的电子式________.
(3)由X和Y两元素可形成C+、D-、E三种微粒(分子或离子),它们都分别含有10个电子,已知它们有转化关系D-+C+=2E;请写出与微粒D-原子种类和个数完全相同但不带电的另一种微粒的电子式________.
完成下列问题:
(1)门捷列夫提出元素周期律,研究元素性质周期性变化时,当时主要是按下列叙述中的哪个顺序排列的( )
①原子序数的递增 ②相对原子质量的递增 ③核外电子排布 ④质子数递增
A.① B.② C.①③ D.①③④
(2)元素周期律的真正基础不是元素的相对原子质量,而是原子序数,也就是原子的核电荷数(或者质子数)。你是如何解释后者比前者更合理的?
(3)门捷列夫提出的元素周期律的基础虽然不是最科学的,但也解释和预测了许多事实,你认为最可能的原因是什么?
查看习题详情和答案>>(1)金原子的核外电子数为_______,中子数为_______。
(2)按现在对原子、分子的认识,你认为道尔顿提出的近代原子学说中不确切的地方,请用" "划出,并在下方加以改正。
(3)根据卢瑟福实验的现象能得出关于金箔中金原子结构的一些结论,试写出其中的三点:
①_________________________________________________;
②_________________________________________________;
③_________________________________________________。
三氟化氮是一种无色、无味、无毒且不可燃的气体、在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥形分子,键角102°,沸点-l29℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是 。
(3)与铜属于同一周期,且未成对电子数最多的元素基态原子核外电子排布式为 。
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是 ,配位数为 。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2080 |
4000 |
6100 |
9400 |
|
R |
500 |
4600 |
6900 |
9500 |
|
S |
740 |
1500 |
7700 |
10500 |
|
T |
580 |
1800 |
2700 |
11600 |
|
U |
420 |
3100 |
4400 |
5900 |
①在周期表中,最可能处于同一族的是 和 。
②T元素最可能是 (填“s”“P” “d”或“ds”等)区元素,位于 族。若T为第2周期元素,F是第3周期元素中原子半径最小的元素,则T与F形成化合物的空间构型为 ,其中心原子的杂化方式为 。
查看习题详情和答案>>