题目内容
全世界每年被腐蚀损耗的钢铁约占全年钢铁产量的
,而在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因.
(1)在潮湿空气中,钢铁发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为
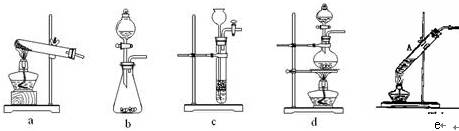
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4
CO↑+CO2↑+H2O,下列装置中,可用作草酸分解制取气体的是
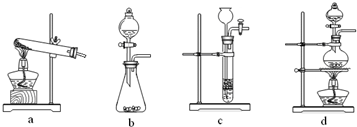
(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3?nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如图所示.

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是
②在点燃酒精灯之前应进行的操作是:(a)检查装置气密性;(b)
③准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=
④在本实验中,下列情况会使测定结果n偏大的是
a.缺少洗气瓶B b.缺少装置E c.反应后固体是铁和少量Fe2O3?nH2O.
| 1 |
| 10 |
(1)在潮湿空气中,钢铁发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为
2Fe+O2+2H2O=2Fe(OH)2
2Fe+O2+2H2O=2Fe(OH)2
.
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4
| 浓硫酸 |
| 加热 |
d
d
.(填字母)(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3?nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如图所示.

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是
浓NaOH溶液
浓NaOH溶液
、浓硫酸
浓硫酸
.②在点燃酒精灯之前应进行的操作是:(a)检查装置气密性;(b)
通入混合气体一段时间
通入混合气体一段时间
.③准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=
2
2
.④在本实验中,下列情况会使测定结果n偏大的是
a
a
.(填字母)a.缺少洗气瓶B b.缺少装置E c.反应后固体是铁和少量Fe2O3?nH2O.
分析:(1)铁的锈蚀实际是铁与空气中的水和氧气共同作用的结果,据此分析;
(2)根据反应物的状态和反应条件选择;
(3)①根据实验目的及二氧化碳的性质分析;
②根据空气的成分及实验要求分析;
③结合方程式,根据固体减少的质量与浓硫酸增重的质量列关系式计算n值;
④根据各装置的作用是否对测定结果n有影响分析判断.
(2)根据反应物的状态和反应条件选择;
(3)①根据实验目的及二氧化碳的性质分析;
②根据空气的成分及实验要求分析;
③结合方程式,根据固体减少的质量与浓硫酸增重的质量列关系式计算n值;
④根据各装置的作用是否对测定结果n有影响分析判断.
解答:解:(1)在潮湿空气中,铁和空气中的氧气及水发生氧化还原反应,所以钢铁发生吸氧腐蚀转化为Fe(OH)2,方程式为:2Fe+O2+2H2O=2Fe(OH)2,
故答案为:2Fe+O2+2H2O=2Fe(OH)2;
(2)该反应的反应物是液体,反应条件是加热,应选择固液反应且需要加热的装置,所以选d,故答案为:d;
(3)①为得到干燥、纯净的CO气,应先除去混合气体中的二氧化碳,用氢氧化钠吸收即可;混合气体通入氢氧化钠溶液时会带走水蒸气,为除去水蒸气,选用浓硫酸洗气,
故答案为:浓NaOH溶液;浓硫酸;
②为防止空气对反应的影响,应先除去各装置中的空气,所以要通入混合气体一段时间,
故答案为:通入混合气体一段时间;
③由题意知,固体质量减少的量为水和氧的量,浓硫酸吸收的量为水,反应方程式为:
Fe2O3.nH2O+3CO=Fe+3CO2+nH2O 质量减少的量为
18ng (18n+48)g
0.72g 10.00g-8.32g
所以0.72g×(18n+48)g=18ng×( 10.00g-8.32g)
解得n=2,故答案为:2;
④a、缺少洗气瓶B会导致装置E增重的质量偏大,所以测定结果n偏大,故a正确;
b、碱石灰吸收的是反应后的二氧化碳,与所测量值无关,所以无影响,故b错误;
c、反应后固体是铁和少量Fe2O3?nH2O,固体减少的质量偏小,导致所测n值偏小,故c错误;
故答案为:a.
故答案为:2Fe+O2+2H2O=2Fe(OH)2;
(2)该反应的反应物是液体,反应条件是加热,应选择固液反应且需要加热的装置,所以选d,故答案为:d;
(3)①为得到干燥、纯净的CO气,应先除去混合气体中的二氧化碳,用氢氧化钠吸收即可;混合气体通入氢氧化钠溶液时会带走水蒸气,为除去水蒸气,选用浓硫酸洗气,
故答案为:浓NaOH溶液;浓硫酸;
②为防止空气对反应的影响,应先除去各装置中的空气,所以要通入混合气体一段时间,
故答案为:通入混合气体一段时间;
③由题意知,固体质量减少的量为水和氧的量,浓硫酸吸收的量为水,反应方程式为:
Fe2O3.nH2O+3CO=Fe+3CO2+nH2O 质量减少的量为
18ng (18n+48)g
0.72g 10.00g-8.32g
所以0.72g×(18n+48)g=18ng×( 10.00g-8.32g)
解得n=2,故答案为:2;
④a、缺少洗气瓶B会导致装置E增重的质量偏大,所以测定结果n偏大,故a正确;
b、碱石灰吸收的是反应后的二氧化碳,与所测量值无关,所以无影响,故b错误;
c、反应后固体是铁和少量Fe2O3?nH2O,固体减少的质量偏小,导致所测n值偏小,故c错误;
故答案为:a.
点评:本题考查了电池反应式的书写、反应装置的选择等知识点,难度不大,注意根据反应物的状态及反应条件选择反应装置.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目

 CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是 (填答案编号)。
CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是 (填答案编号)。

 CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是 ▲ 。(填字母)
CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是 ▲ 。(填字母)

 进行的操作是:(a)检查装置气密性;(b) ▲ 。
进行的操作是:(a)检查装置气密性;(b) ▲ 。 CO↑ + CO2↑ + H2O,
CO↑ + CO2↑ + H2O,