网址:http://m.1010jiajiao.com/timu3_id_297918[举报]

Ⅱ.已知X、Y、Z、W是短周期中的四种非金属元素,它们的原子序数依次增大。X元素原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子方程式为:____________。
(2)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量的NaOH溶液反应的离子方程式为____________。
(3)将9 g Y单质在足量W单质中燃烧。所得气体通入1 L 1 mol·L-1的NaOH溶液中,完全吸收后,溶液中的离子浓度由大到小的顺序是____________。
查看习题详情和答案>>
C(s)+1/2O2(g)==CO(g) △H=-110.5kJ/mol
2Fe(s)+3/2O2(g)===Fe2O3(s) △H=-822.1kJ/mol
请写出C还原Fe2O3生成CO的热化学方程式___________________________。
(2)反应2CO+O2
 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2 2Fe2O3的平衡常数K2,则反应
2Fe2O3的平衡常数K2,则反应3CO+Fe2O3
 2Fe+3CO2的平衡常数K与K1、K2的关系式___________。
2Fe+3CO2的平衡常数K与K1、K2的关系式___________。(3)高温下,氧化铁能跟碳发生下列反应:
① Fe2O3+3C
 2Fe+3CO ② Fe2O3+3CO
2Fe+3CO ② Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2 若反应产生的气体是CO2和CO,则
 的取值范围是_________________。
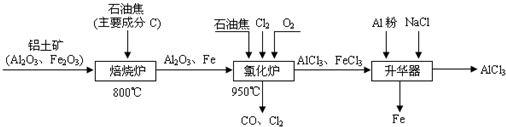
的取值范围是_________________。(4)氯化炉中生成的气体,通常用碱性的亚硫酸钠溶液来吸收,请用离子方程式分析亚硫酸钠溶液呈碱性的原因____________________。
(5)氯化炉中发生:3Cl2(g)+3C(s)+Al2O3(s)
 2AlCl3(g)+3CO(g) △H>0,欲提高金属铝的氯化效果,不可采取的措施是______(填序号):
2AlCl3(g)+3CO(g) △H>0,欲提高金属铝的氯化效果,不可采取的措施是______(填序号): ①增加C的量 ②多通入Cl2 ③升高温度 ④移走部分AlCl3(g)
⑤使用合适的催化剂工业上还常采用向氯化炉中通入O2的方法,其目的是________________。
(6)沉淀分析法一般规定:溶液中某离子物质的量浓度低于1.0×10-5 mol/L时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2mol/L。此时所得沉淀中_____(填“是”或“否”)含有Al(OH)3。(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33)。
(1)已知:C(s)+
| 1 |
| 2 |
| 3 |
| 2 |
请写出C还原Fe2O3生成CO的热化学方程式______.
(2)反应2CO+O2
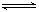
2CO2的平衡常数为K1;反应4Fe+3O2
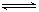
2Fe2O3的平衡常数K2,则反应3CO+Fe2O3
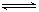
2Fe+3CO2的平衡常数K与K1、K2的关系式______.
(3)高温下,氧化铁能跟碳发生下列反应:
①Fe2O3+3C
| ||
| ||
| n(C) |
| n(Fe2O3) |
(4)氯化炉中生成的气体,通常用碱性的亚硫酸钠溶液来吸收,请用离子方程式分析亚硫酸钠溶液呈碱性的原因______.
(5)氯化炉中发生:3Cl2(g)+3C(s)+Al2O3(s)
2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是______(填序号):
①增加C的量 ②多通入Cl2③升高温度 ④移走部分AlCl3(g) ⑤使用合适的催化剂工业上还常采用向氯化炉中通入O2的方法,其目的是______.
(6)沉淀分析法一般规定:溶液中某离子物质的量浓度低于1.0×10-5mol/L时,可认为已沉淀完全.现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2mol/L.此时所得沉淀中______(填“是”或“否”)含有Al(OH)3.(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33).
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol?L-1H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁:向步骤Ⅱ所得溶液中加入过量氨水.
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
请回答:
(1)步骤Ⅱ中,可用于调节溶液pH至7~8的最佳试剂是
A.MgO B.Na2CO3 C.蒸馏水
(2)检验粗硫酸镁溶液中Fe2+的方法是:
(3)步骤Ⅲ中制备氢氧化镁反应的离子方程式为
(4)步骤Ⅱ沉淀后溶液中主要存在(NH4)2SO4,已知室温下0.1mol?L-1的(NH4)2SO4溶液pH是5,则溶液中离子浓度由大到小的排列为
(5)某生产科研小组经查阅资料得到以下溶度积Ksp数据(298K时):
Mg(OH)2(S)?Mg2+(aq)+2OH-(aq) Ksp=[Mg2+]?[OH-]2=5.6×10-12
Ca(OH)2(S)?Ca2+(aq)+2OH-(aq) Ksp=[Ca2+]?[OH-]2=4.7×10-6
该科研小组认为可以用熟石灰替代氨水制得氢氧化镁,他们的理由是
若沉淀转化反应为:Mg2+(aq)+Ca(OH)2(S)?Mg(OH)2(S)+Ca2+(aq),求此温度下该反应的化学平衡常数K=
(16分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量头铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。
请回答下列问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是_____。
(3)已知:25℃、101kpa时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是
_ _。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是______。
(6)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2___________kg。