网址:http://m.1010jiajiao.com/timu3_id_296162[举报]
(10分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;
(2)氯化铝水溶液呈 性 ,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表
示): ;
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3) 已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用:
请回答下列问题:
①在上图的括号内应填的是在_______________环境中加热。
②Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固) ![]() Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
③已知AnBm的离子积=c (Am+) n ·c (Bn-) m,式中c (Am+) n和c (Bn-) m表示离子的物质的量浓度,在室温时若测得Mg(OH)2饱和溶液的pH值为11,其离子积为___________________。
查看习题详情和答案>>
(10分)温家宝总理多次指出要大力抓好节能降耗、保护环境。请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”。下列化学反应不符合“绿色化学”思想的是 ____________________。
A.制备环氧乙烷: |
B.制备硫酸铜Cu+2H2SO4 CuSO4+SO2↑+2H2O CuSO4+SO2↑+2H2O |
C.制备甲醇: 2CH4+O2 2CH3OH 2CH3OH |
| D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O |
(3)工业上目前使用两种方法制取乙醛——“乙炔水化法”和“乙烯氧化法”。下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
| | 乙炔水化法 | 乙烯氧化法 |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
表二:原料来源生产工艺
| | 原料生产工艺过程 |
| 乙炔 |   |
| 乙烯 | 来源于石油裂解气 |
①从产率和产量角度分析 。
②从环境保护和能耗角度分析 。 查看习题详情和答案>>
(10分)江苏省拥有很长的海岸线,具有丰富的海洋资源,因此盐化工是本省的一个重要产业。从盐卤初步得到的光卤石(KCl·MgCl2·6H2O)晶体中,还含有约8%的NaCl。
为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
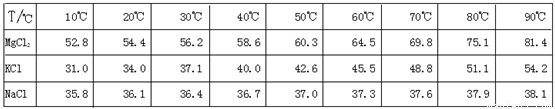
并设计出下面的实验流程:

根据他们提供的数据和实验回答下列问题:
问题1:以上实验流程中晶体X的化学式为 ,若制得的X还含有少量的可溶性杂质,可用
的方法进一步提纯。操作步骤①中趁热过滤的原因是:
问题2:工业上采用电解无水氯化镁的方法制取金属镁。
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:
(2)该小组同学采取将浓硫酸滴入浓盐酸制取氯化氢气体的方法,用下图的实验装置,在干燥的HCl气流中加热MgCl2·6H2O来得到无水MgCl2。装置中盛有浓硫酸的仪器分别
是 (填写仪器的符号),需要加热的仪器是 (同上)。
(3)为防止对环境的污染,还需要将尾气吸收,但实验室现有的仪器和试剂只有:烧杯、导管、蒸馏水、酒精、苯、四氯化碳。请你为他们设计一个尾气的吸收装置,将装置图画在方框内并在图中标明所用试剂。
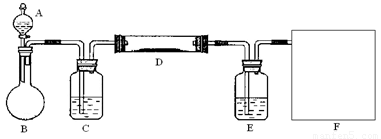
查看习题详情和答案>>
(10分)温家宝总理多次指出要大力抓好节能降耗、保护环境。请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”。下列化学反应不符合“绿色化学”思想的是 ____________________。
A.制备环氧乙烷:
B.制备硫酸铜Cu+2H2SO4 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
C.制备甲醇: 2CH4+O2 2CH3OH
2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2]-,其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强。工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为 _____________________________,在酸性条件下,ClO-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因是 ____________________________________________________________。
(3)工业上目前使用两种方法制取乙醛——“乙炔水化法”和“乙烯氧化法”。下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
|
|
乙炔水化法 |
乙烯氧化法 |
|
原料 |
乙炔、水 |
乙烯、空气 |
|
反应条件 |
HgSO4、100~125℃ |
PdCl2-CuCl2、100~125℃ |
|
平衡转化率 |
乙炔平衡转化率90%左右 |
乙烯平衡转化率80%左右 |
|
日产量 |
2.5吨(某设备条件下) |
3.6吨(相同设备条件下) |
表一:原料、反应条件、平衡转化率、日产量
表二:原料来源生产工艺
|
|
原料生产工艺过程 |
|
乙炔 |
|
|
乙烯 |
来源于石油裂解气 |
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因。
①从产率和产量角度分析 。
②从环境保护和能耗角度分析 。
查看习题详情和答案>>


 ⑷由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为:
⑷由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: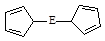 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有
种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有
种峰。