摘要:已知在101kPa下.298K条件下.2mol氢气完全燃烧生成水蒸汽放出484kJ热量.下列热化学方程式正确的是 (A) H2O(g)=H2(g)+1/2O2(g),ΔH= +242kJ·mol-1 (B)2H2(g)+O2(g)=2H2O(l),ΔH= -484kJ·mol-1 (C)H2(g)+1/2O2(g)=2H2O(g),ΔH= +242kJ·mol-1 (D) 2H2(g)+O2(g)=2H2O(g),ΔH= +484kJ·mol-1
网址:http://m.1010jiajiao.com/timu3_id_294795[举报]
 硫酸生产过程中关键阶段的反应为:
硫酸生产过程中关键阶段的反应为:2SO2(g)+O2(g)
| 催化剂 | 加热 |
(1)能判断该反应达到化学平衡状态的依据是
A.容器中气体密度保持不变
B.混合气体中c(SO3)不再发生变化
C.2v正(SO2)═v逆(O2)
D.c(SO2)═c(SO3)
(2)反应达到平衡时,测得SO3的体积分数为40.0%,则SO2的转化率为
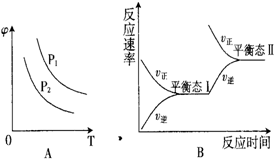
(3)如图A为在不同温度、不同压强下达到平衡时,混合气体中SO3的体积分数φ随度变化的曲线.图B为恒温下平衡态I到平衡态Ⅱ的变化,下列说法正确的是
A.图A中P1>P2
B.图A中P1<P2
C.图B为减小体系压强,平衡发生移动,达到平衡态Ⅱ
D.图B为增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
(4)我国工业制备SO2常用煅烧FeS2方法,而有的国家用燃烧S制备SO2.已知在101kPa时,4g硫粉在氧气中完全燃烧生成SO2,放出27kJ的热量,硫的燃烧热为
已知:
①101kPa下,2C(石墨,s)+O2(g)=2CO(g)△H=-221kJ?mol-1
②C(石墨,s)=C(金刚石,s)△H=-1.91kJ?mol-1
③在稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1,下列有关说法正确的是( )
①101kPa下,2C(石墨,s)+O2(g)=2CO(g)△H=-221kJ?mol-1
②C(石墨,s)=C(金刚石,s)△H=-1.91kJ?mol-1
③在稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1,下列有关说法正确的是( )
| A、金刚石比石墨稳定 | B、石墨的热值比9.2kJ?g-1大 | C、所有强酸与强碱反应生成1molH2O时放出的热量都为57.3kJ | D、1mol醋酸与1mol氢氧化钠在稀溶液中完全反应时,放出的热量大于57.3kJ |
CO、CH4均为常见的可燃性气体.
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是
(2)已知在101kPa时,CO的燃烧热为283kJ/mol.相同条件下,若2molCH4完全燃烧生成液态水,所放出的热量为1mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是
(3)120℃、101kPa下,a mL由CO、CH4组成的混合气体在b mLO2中完全燃烧后,恢复到原温度和压强.
①若混合气体与O2恰好完全反应,产生bmL CO2,则混合气体中CH4的体积分数为
②若燃烧后气体体积缩小了
mL,则a与b关系的数学表达式是
查看习题详情和答案>>
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是
1:4
1:4
(2)已知在101kPa时,CO的燃烧热为283kJ/mol.相同条件下,若2molCH4完全燃烧生成液态水,所放出的热量为1mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是
CH4(g)+2O2(g)=CO2(g)+2H2O(1);△H=-891.45kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(1);△H=-891.45kJ/mol
.(3)120℃、101kPa下,a mL由CO、CH4组成的混合气体在b mLO2中完全燃烧后,恢复到原温度和压强.
①若混合气体与O2恰好完全反应,产生bmL CO2,则混合气体中CH4的体积分数为
0.33
0.33
(保留2位小数).②若燃烧后气体体积缩小了
| a |
| 4 |
b≥
a
| 5 |
| 4 |
b≥
a
.| 5 |
| 4 |
物质A、B、C、D为中学常见单质,其组成元素的原子序数依次减小,且其中只有三种是短周期元素,B为黄绿色气体.试根据图中物质的相互转化关系回答下列问题.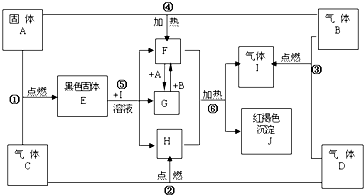
(1)A是
(2)在F
G的转化中,A的作用是 ;在①~⑥的反应中,不属于氧化还原反应的是 .(多填或少填无分)
(3)写出A在高温下与H反应的化学反应方程式并标出电子转移的方向和数目 .
(4)写出反应⑥的化学反应方程式 .
(5)已知在101kPa 条件下,2mol D完全燃烧生成液态生成物放出571.6kJ热量;请书写表示D燃烧热的热化学方程式: .
查看习题详情和答案>>

(1)A是
(2)在F
| A |
(3)写出A在高温下与H反应的化学反应方程式并标出电子转移的方向和数目
(4)写出反应⑥的化学反应方程式
(5)已知在101kPa 条件下,2mol D完全燃烧生成液态生成物放出571.6kJ热量;请书写表示D燃烧热的热化学方程式:
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图1表示该反应进行过程中能量的变化.
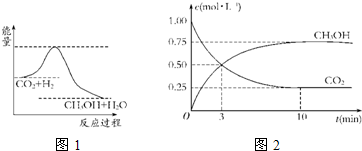
(1)关于该反应的下列说法中,正确的是
A.△H>0,△S>0; B.△H>0,△S<0;
C.△H<0,△S<0; D.△H<0,△S>0.
(2)该图中能量的最高点和最低点之间的差值代表
(3)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2
和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡用氢气浓度变化表示的平均反应速率v(H2)
(4)肼(N2H4)是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:
查看习题详情和答案>>

(1)关于该反应的下列说法中,正确的是
C
C
.A.△H>0,△S>0; B.△H>0,△S<0;
C.△H<0,△S<0; D.△H<0,△S>0.
(2)该图中能量的最高点和最低点之间的差值代表
逆反应的活化能
逆反应的活化能
(3)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2
和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡用氢气浓度变化表示的平均反应速率v(H2)
0.225
0.225
mol?L-1?min-1.(4)肼(N2H4)是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:
N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol
.