网址:http://m.1010jiajiao.com/timu3_id_294567[举报]
CH3COOH![]() CH3COO-+H+(电离平衡)
CH3COO-+H+(电离平衡)
Ca(OH)2(s) ![]() Ca2++2OH-(溶解平衡)
Ca2++2OH-(溶解平衡)
*Fe3++SCN-![]() [Fe(SCN)]2+(络合平衡)等
[Fe(SCN)]2+(络合平衡)等
难溶于水的盐在水中存在溶解平衡,其饱和溶液(达到溶解平衡时的溶液)中各离子的浓度遵循一定的定量关系。例如AgCl在水中存在平衡:AgCl![]() Ag++Cl-,在一定温度下,饱和溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用Ksp表示,Ksp=c(Ag+)·c(Cl-)。已知碳酸钙和氢氧化钙在水中存在下列溶解平衡:Ca(OH)2(s)
Ag++Cl-,在一定温度下,饱和溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用Ksp表示,Ksp=c(Ag+)·c(Cl-)。已知碳酸钙和氢氧化钙在水中存在下列溶解平衡:Ca(OH)2(s)![]() Ca2++2OH-,CaCO3(s)
Ca2++2OH-,CaCO3(s)![]() Ca2++CO
Ca2++CO![]() 。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等。为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等。为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
思考:(1)写出上述两个反应的化学方程式。
(2)试说明用熟石灰的悬浊液而不用澄清石灰水的理由。
查看习题详情和答案>>已知碳酸钙和氢氧化钙在水中存在下列溶解平衡Ca(OH)2(固)![]() Ca2++2OH-,CaCO3(固)
Ca2++2OH-,CaCO3(固)![]() Ca2++
Ca2++![]() .在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2,CO2等,为了除去有害气体SO2变废为宝,常常见粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏.
.在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2,CO2等,为了除去有害气体SO2变废为宝,常常见粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏.
(1)写出上述两个反应的化学方程式:
①SO2与CaCO3悬浊液反应________;
②SO2与Ca(OH)2悬浊液反应________.
(2)试说明用熟石灰的悬浊液而不用澄清石灰水的理由________.
用化学反应速率与化学平衡及平衡移动的原理可以分析诸类平衡,如:(电离平衡)CH3COOH![]() CH3COO-+H+、(溶解平衡)Ca(OH)2(s)
CH3COO-+H+、(溶解平衡)Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq)、(络合平衡)Fe3++SCN-=[Fe(SCN)]2+等.难溶于水的盐在水中存在溶解平衡,其饱和溶液(达到溶解平衡时的溶液)中各离子的浓度遵循一定的定量关系.例如AgCl在水中存在平衡:AgCl
Ca2+(aq)+2OH-(aq)、(络合平衡)Fe3++SCN-=[Fe(SCN)]2+等.难溶于水的盐在水中存在溶解平衡,其饱和溶液(达到溶解平衡时的溶液)中各离子的浓度遵循一定的定量关系.例如AgCl在水中存在平衡:AgCl![]() Ag++Cl-.在一定温度下,饱和溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用Ksp表示Ksp=c(Ag+)·c(Cl-).已知碳酸钙和氢氧化钙在水中存在下列溶解平衡:Ca(OH)2(s)
Ag++Cl-.在一定温度下,饱和溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用Ksp表示Ksp=c(Ag+)·c(Cl-).已知碳酸钙和氢氧化钙在水中存在下列溶解平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq);2CaCO3(s)
Ca2+(aq)+2OH-(aq);2CaCO3(s)![]()
![]() .在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等.为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏.
.在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等.为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏.
思考题:
(1)写出上述两个反应的化学方程式.
(2)试说明用熟石灰的悬浊液而不用澄清石灰水的理由.
(1)为确定白色粉末的成分,实验时需要用到两种物质性质的不同点.试举一例:
反应无气体生成)
反应无气体生成)
(2)同学们设计了以下三种实验方案:
方案 I:取样品加入试管中,滴加稀盐酸,有气泡产生则白色粉末是碳酸钙.
方案 II:取样品加入试管中,滴加稀盐酸,无气泡产生则白色粉末是氢氧化钙.
方案 III:取样品加入试管中,加水振荡,静置,下层有不溶物,上层清液中滴入酚酞溶液,溶液变红,则白色粉末是碳酸钙和氢氧化钙的混合物.
以上三种方案中,你认为不合理的是
请你再设计一种方案,证明该粉末是两种物质的混合物,简要写出实验的操作步骤及现象.
| 实验操作步骤 | 实验现象 |
1、取少量该白色粉末放入试管中,加2mL水振荡,滴加几滴无色的酚酞溶液 2、另取少量白色粉末放在试管中,滴加适量盐酸 1、取少量该白色粉末放入试管中,加2mL水振荡,滴加几滴无色的酚酞溶液 2、另取少量白色粉末放在试管中,滴加适量盐酸 |
酚酞试液变红 有气泡生成 酚酞试液变红 有气泡生成 |
阿魏酸在医药、保健品、化妆品原料和食品添加剂等方面有着广泛的用途,其
结构简式为

⑴阿魏酸可以发生 (填选项字母)。"
a.酯化反应 b.消去反应 c.加成反应 d.氧化反应 e.银镜反应
⑵阿魏酸的一种同分异构体A 可用于制备有机玻璃(聚甲基丙烯酸甲酯),转化关系如下图所示:
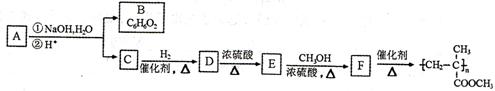
己知A 和B都能与FeCl3溶液发生显色反应,B的一溴代物只有一种,A、C能发生银镜反应。
①B的结构简式为____________,C含有的官能团为____________。
②D→E的化学方程式为____________________________________。
③A的结构简式为__________________________________________。
(3)写出所有符合下列条件的阿魏酸的同分异构体的结构简式。
①苯环上有两个取代基,且苯环上的一漠代物只有2 种;
②能发生银镜反应;
③与碳酸氢钠溶液反应可放出使澄清石灰水变浑浊的气体;
④与FeCl3 溶液发生显色反应__________________________________________。
查看习题详情和答案>>