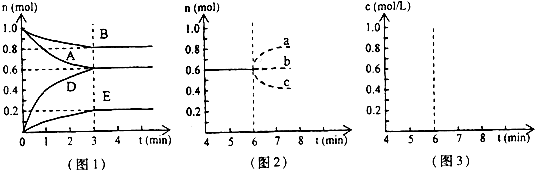
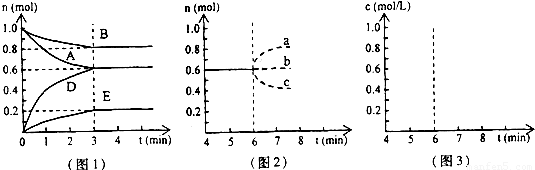
题目内容
用化学反应速率与化学平衡及平衡移动的原理可以分析诸类平衡,如:CH3COOH![]() CH3COO-+H+(电离平衡)
CH3COO-+H+(电离平衡)
Ca(OH)2(s) ![]() Ca2++2OH-(溶解平衡)
Ca2++2OH-(溶解平衡)
*Fe3++SCN-![]() [Fe(SCN)]2+(络合平衡)等
[Fe(SCN)]2+(络合平衡)等
难溶于水的盐在水中存在溶解平衡,其饱和溶液(达到溶解平衡时的溶液)中各离子的浓度遵循一定的定量关系。例如AgCl在水中存在平衡:AgCl![]() Ag++Cl-,在一定温度下,饱和溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用Ksp表示,Ksp=c(Ag+)·c(Cl-)。已知碳酸钙和氢氧化钙在水中存在下列溶解平衡:Ca(OH)2(s)
Ag++Cl-,在一定温度下,饱和溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用Ksp表示,Ksp=c(Ag+)·c(Cl-)。已知碳酸钙和氢氧化钙在水中存在下列溶解平衡:Ca(OH)2(s)![]() Ca2++2OH-,CaCO3(s)
Ca2++2OH-,CaCO3(s)![]() Ca2++CO
Ca2++CO![]() 。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等。为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等。为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
思考:(1)写出上述两个反应的化学方程式。
(2)试说明用熟石灰的悬浊液而不用澄清石灰水的理由。
(1)2SO2+O2+2CaCO3===2CaSO4+2CO2(或生成2CaSO4·2H2O)
2SO2+O2+2Ca(OH)2===2CaSO4+2H2O(或生成2CaSO4·2H2O)
(2)Ca(OH)2微溶于水,石灰水中Ca(OH)2浓度小,吸收SO2的量较少,且吸收速率较慢。

化学反应速率与化学平衡在日常生活、工农业生产和科学研究中具有重要的意义,在
化学实验中涉及的电离平衡也属于化学平衡。请回答下列问题:
(1)某研究性学习小组查阅资料发现金属氧化物A也能催化氯酸钾的分解,且A和二
氧化锰的最佳催化温度均为500℃左右。于是对A和二氧化锰的催化性能进行了
定量对照实验。实验时均以收满500 mL氧气为准(其他可能影响实验的因素均已
忽略)。
表一 用MnO2作催化剂
| 实验序号 | KClO3质量/g | MnO2质量/g | 反应温度/℃ | 待测数据 |
| 1 | 8.00 | 2.00 | 500 | |
| 2 | 8.00 | 2.00 | 500 |
表二 用A作催化剂
| 实验序号 | KClO3质量/g | A的质量/g | 反应温度/℃ | 待测数据 |
| 1 | 8.00 | 2.00 | 500 | |
| 2 | 8.00 | 2.00 | 500 |
请回答:上述实验中的待测数据应是 。
完成此研究后,他们准备发表一篇研究报告,请你替他们拟一研究报告的标题:
。
(2)氨水是一种弱碱,某同学取0.1mo/L的氨水,用pH试纸测其pH,结果发现溶液的
pH约为11,以此得出氨水为弱碱的结论。该同学用pH试纸测定氨水pH的具体操
作是 。
(3)证明氨水是弱碱的常用方法还有两种:一是设法证明NH![]() 的水解,一是设法使氨水
的水解,一是设法使氨水
电离平衡发生移动。
方法一:取少量NH4Cl晶体溶于水,滴入石蕊试液,溶液变红,可见溶液显酸性。
其原因是 。
方法二:取少量氨水,滴入酚酞变红后再加入 ,振荡,红色变浅,c(OH—)下降,说明氨水的电离平衡向 移动。
 pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).