摘要:水的离子积常数KW与温度t(℃)的关系如右图所示: (1)若t1=25℃,则KW1= ,若t2=100℃时.KW2= 10-12.则0.05mol·L-1的Ba(OH)2溶液的pH= . (2)已知25℃时.0.1L0.1mol·L-1的NaA溶液的pH=10,则 NaA溶液中所存在的化学平衡有: .溶液中各离子的物质的量浓度由大到小的顺序为 . (3)25℃时.将pH=11的NaOH溶液与pH=4的硫酸溶液混合.若所得混合溶液pH=9.则NaOH溶液与硫酸溶液的体积比为 . (4)100℃时.若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性.则混合之前.该强碱的pH(pH酸)与强碱的pH(pH碱)之间应满足的关系为: pH= . 溶液的酸碱性.pH 值及计算 重点回顾: ⒈定义:PH= .广泛pH的范围为0-14. 注意:当溶液中[H+]或[OH-]大于1mol/L时.不用pH表示溶液的酸碱性. ⒉溶液的酸碱性: 溶液的酸碱性 常温 中性溶液:C(H+) C(OH-) C(H+) 1×10- 7mol/L pH 7 酸性溶液:C(H+) C(OH-) C(H+) 1×10-7mol/L pH 7 碱性溶液:C(H+) C(OH-) C(H+) 1×10-7mol/L pH 7 ⒊溶液PH的测定方法 (1)酸碱指示剂法 说明:常用的酸碱指示剂有石蕊.甲基橙.酚酞试液. 常用酸碱指示剂的pH变色范围 指示剂 变色范围的pH 石蕊 <5 色 5-8 色 >8 色 甲基橙 <3.1 色 3.1-4.4 色 >4.4 色 酚酞 <8 色 8-10 色 >10 色 (2)pH试纸法 使用方法: (3)PH计法
网址:http://m.1010jiajiao.com/timu3_id_294493[举报]
(14分)在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
(1)依据题意判断,t℃___________25℃(填“大于”、“小于”或“等于”),该温度下水的离子积常数Kw = ___________。
(2)b=____________,x =" ______mL" 。
(3)反应③的离子方程式为____________________________
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中
c(Ba2+)﹕c(OH-)= ;
(5) 与NaHSO4相同, NaHSO3和NaHCO3也为酸式盐。已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是___________(填正确答案的标号)。
A.c(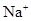 )>c(
)>c(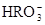 )>c(
)>c(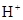 )>c(
)>c(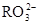 )>c(
)>c(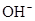 )
)
B.c(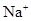 )+c(
)+c(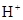 )=c(
)=c(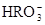 )+2c(
)+2c(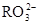 )+c(
)+c(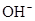 )
)
C.c(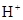 )+c(
)+c(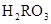 )=c(
)=c(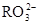 )+c(
)+c(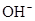 )
)
D.两溶液中c(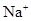 )、c(
)、c(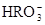 )、c(
)、c(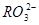 )分别相等
)分别相等
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
(2)b=____________,x =" ______mL" 。
(3)反应③的离子方程式为____________________________
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中
c(Ba2+)﹕c(OH-)= ;
(5) 与NaHSO4相同, NaHSO3和NaHCO3也为酸式盐。已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是___________(填正确答案的标号)。
A.c(
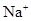 )>c(
)>c(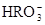 )>c(
)>c(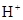 )>c(
)>c(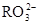 )>c(
)>c(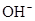 )
)B.c(
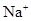 )+c(
)+c(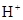 )=c(
)=c(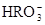 )+2c(
)+2c(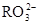 )+c(
)+c(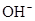 )
)C.c(
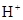 )+c(
)+c(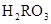 )=c(
)=c(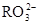 )+c(
)+c(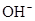 )
)D.两溶液中c(
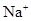 )、c(
)、c(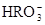 )、c(
)、c(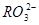 )分别相等
)分别相等Ⅰ.已知:H2A的A2-可表示S2-、S 、S
、S 、Si
、Si 或C
或C 等离子。
等离子。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空: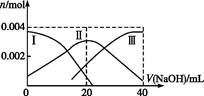
①当V(NaOH)="20" mL时,溶液中离子浓度大小关系: 。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水 (填“大”“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入 。
(2)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW= 。
Ⅱ.已知:在25 ℃时 H2O H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为 ,具体数值= ,当升高温度时,Kh将 (填“增大”“减小”或“不变”)。
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 。(填“大于”“小于”或“等于”)
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
Ⅰ.已知:H2A的A2-可表示S2-、S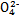 、S
、S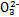 、Si
、Si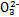 或C
或C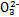 等离子。
等离子。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:
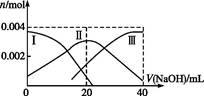
①当V(NaOH)="20" mL时,溶液中离子浓度大小关系: 。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水 (填“大”“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入 。
(2)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW= 。
Ⅱ.已知:在25 ℃时 H2O H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为 ,具体数值= ,当升高温度时,Kh将 (填“增大”“减小”或“不变”)。
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 。(填“大于”“小于”或“等于”)
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
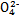 、S
、S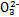 、Si
、Si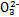 或C
或C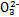 等离子。
等离子。(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:

①当V(NaOH)="20" mL时,溶液中离子浓度大小关系: 。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水 (填“大”“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入 。
(2)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW= 。
Ⅱ.已知:在25 ℃时 H2O
 H++OH- KW=10-14
H++OH- KW=10-14CH3COOH
 H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5(3)醋酸钠水解的平衡常数Kh的表达式为 ,具体数值= ,当升高温度时,Kh将 (填“增大”“减小”或“不变”)。
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 。(填“大于”“小于”或“等于”)
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a
 b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。 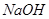 稀溶液中,
稀溶液中,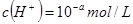 ,
,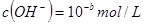 ,已知
,已知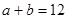 ,则:
,则: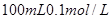 的稀硫酸与
的稀硫酸与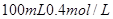 的
的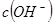 =_________。
=_________。 体积
体积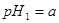 的某强酸溶液与1体积
的某强酸溶液与1体积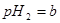 的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
的某强碱溶液混合后溶液呈中性,则混合前,该强酸的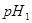 与强碱的
与强碱的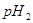 之间应满足的关系是_________。
之间应满足的关系是_________。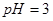 的硫酸溶液和
的硫酸溶液和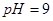 的
的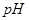 _________(填>7、=7、<7);
_________(填>7、=7、<7);